

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المدارات الذرية المهجنة
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اساسيات الكيمياء العضوية
الجزء والصفحة:
ص22- 21 -20
2023-07-01
1589
إذا فرضنا أن الروابط التساهمية بين العناصر الخفيفة تتكون من تداخل مدارات من نوع P,S فقد وجد ان الخواص المتوقعة لكثير من هذه الروابط لا تشبه خواص الرابطة الفعلية في الجزيئة .
ومع ذلك يمكن إيجاد علاقة من الخواص المتوقعة للرابطة وخواصها الفعلية إذا وضحنا المدار الجزيئي باستعمال مدارات ذرية مهجنة . والمدارات الذرية المهجنة هي مدارات تحصل على خواصها من جمع المدارات. (S,P,d,f )
ويمكن وصف معظم المركبات العضوية بأستعمال ثلاث من هذه المدارات المهجنة وهى .SP , SP2 , SP3 فالوصف الرياضي لمدار( ( SP3المهجنة يحدث بجمع الأوصاف الرياضية لمدار (SP3) ومدارات ( P )وبطريقة مماثلة يعتبر (SP2) هجينا من مدار (S) ومداري ( Px , Py) .
كما يعد المدار (SP) هجينا من مدار (S) ومدار (Px) ويكون الترتيب الالكتروني لغلاف ذرة الكربون الخارجي في حالتها الاعتيادية هو :
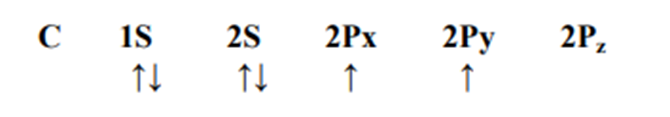
ومنه يستدل على ان ذرة الكربون قادرة على تكوين رابطتين فقط. غير أن المعروف أن الكربون قادر على تكوين مركبات يكون فيها رباعي التكافؤ ولغرض تحقيق ذلك ينتقل إلكترون من المدار ( S2( الى المدار (Pz (2 وبذلك يحدث الترتيب الالكتروني التالي الذي يسمح لذرة الكربون بتكوين أربع روابط منفردة . وتتداخل المدارات الأربعة هذه وتتهجن مكونة أربعة مدارات جديدة متكافئة في الحجم والشكل .
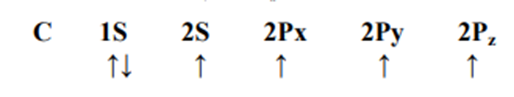
وترتب نفسها حول ذرة الكربون بشكل رباعي السطوح بحيث تكون الزوايا الأربعة متساوية (109.5°) وتعرف هذه المدارات (SP3) كمـا فـــي
الشكل التالي :

وتستعمل ذرة الكربون مداراتها الذرية (SP3) لتكوين روابط منفردة عن ارتباطها بأربع ذرات أخرى كمـا فـي الميثان (CH4) إذا ارتبطت ذرة الكربون بثلاث ذرات أخرى كما في الفورمالديهيد (CH2O) فأنها تستعمل مدارات (SP2) بالإضافة إلى مدار (P) واحد لتكوين روابطها .
وإذا ارتبطت ذرة الكربون بذرتين أخرتين كما في الاثيلين (C2H2) فإنها تستعمل مدارات (SP3) المهجنة عند ارتباطها بثلاث ذرات أخرى بروابط منفردة كما في الأمونيا (NH3) .