

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
حاصل الإذابة The solubility product
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص58-59
2023-09-13
1415
عند مزج محلول كلوريد الصوديوم مع محلول نترات الفضة ( تركيز كل منهما علي سبيل المثال 0.1 ) يظهر راسب كلوريد الفضة مباشرة ويكون هذا الراسب في حالة اتزان مع أيونات الكلوريد والفضة في المحلول هذا المحلول بأنه مشبع براسب كلوريد الفضة لهذا فإن·
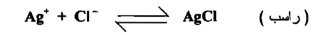
من الحقائق التجريبية انه في مثل هذا المحلول المشبع يكون حاصل ضرب تركيز أيونات الكلوريد ثابتاً عند ثبوت درجة الحرارة ويطلق علي هذة القيمة الثابتة بأنهـا حاصل الإذابة لكلوريد الفضة K sp
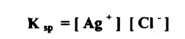
وبصورة عامة ، فإن الملح شحيح الذوبان Aa,Bb الذي يتأين حسب المعادلة
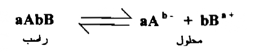
فأن حاصل الاذابة عند ثبوت درجة الحرارة هي :

لهذا فإن حاصل الإذابة لملح شحيح يعرف بأنه حاصل ضرب التركيز المولاري للأيونات الموجودة في المحلول مرفوعاً لأس عدد الأيونات المتضمنة في معادلة الاتزان الكيميائي للمحلول المشبع.
يتضح من معادلة حاصل الإذابة بأن تركيز الأيونات في المحلول يمكن أن يتغير لكن حاصل ضرب تركيز هذه الأيونات يجب أن يبقي ثابتاً ما دام راسب الملح موجوداً وأن درجة الحرارة ثابتة .