

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
نظرية معايرات التعادل Theory of Neutralization Titrations
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص 165 -167
2023-09-17
1633
أن نقطة النهاية في تفاعلات التعادل تعتمد عادة على التغير الحاصل في رقم ( الأس الهيدروجيني ) والذي يحدث قرب نقطة التكافؤ . وأن مدي الأس الهيدروجيني الذي يظهر فيه هذا التغير يعتمد علي طبيعة المحلول وتركيزه . ويستعمل الدليل المناسب في تفاعلات التعادل عن طريق اختيار الدليل بواسطة منحنيات التعادل Titration Curves
تتم هذه التفاعلات بين الأحماض أو المحاليل الحامضية والقواعد أو المحاليل القاعدية كما يلي :
تعريف الأحماض والقواعد والأملاح :
يعرف الحامض استناداً إلى نظرية التاين لأرهينوس بأنه المادة التي تتأين في الماء لتعطي أيونات الهيدروجين
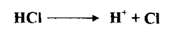
وقد عرفت القاعدة كذلك بأنها مادة تتأين في الماء معطية أيونات الهيدروكسيل

كما يتحد الماء نفسه ، اذ أن جزيئاً من الماء ينتقل بروتوناً إلى الجزيئة الثانية كما التفاعل التالي :
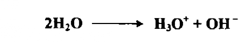
وقد أتضح أن أيون الهيدروجين+ H لا يمكن أن يوجد في المحاليل المائية إلا بدرجة تركيز ضئيلة للغاية وان هذا الأيون يتحد بالماء بدرجة كبيرة كما تدل على ذلك حرارة التفاعل :
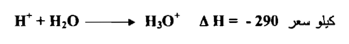
والواقع أن ايون الهيدروجين يتحد بأكثر من جزئ من جزيئات الماء ويسمي الأيونH3O أيون الهيدرونيوم

كما يتكون الأيون NH4+ في سائل الأمونيا
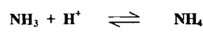
كذلك الحال في القواعد فبالرغم من أن هيدروكسيد الصوديوم قاعدة قوية في الماء إلا أنه يتأين بدرجة أقل من الكحول الايثيلي الخالي من الماء ويصبح قاعدة أضعف من أيثوكسيد الصوديوم C2H5ONa التي تكون الأيون C2H5O . ويمكن تعريف الملح بأنه المادة التي تتكون من مجموعة من الذرات المشحونة أو مجاميع من الذرات المشحونة المرتبطة ببعضها مكوناً شكلاً بلورياً مميزاً والتي عند إذابتهـا فـــي الماء أو تسخينها لدرجة انصهارها فإن القوي التي تربط ذراتها تضعف فتتحلل المادة إلى مكوناتها المشحونة علي صورة أيونات تحمل شحنات كهربائية موجبة وسالبة ولها القدرة على نقل التيار الكهربائي مثل .
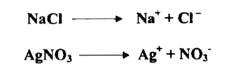
تسمى الأيونات الموجبة بالكاتيونات Cations والأيونات السالبة بالأنيونات Anions وتسمي الذرات المشحونة التي تتكون نتيجة فقدان الالكترونات أو اكتسابها بالأيونات، تسمي الأيون المشحون بالشحنة الموجة كاتيون Cation يسمي الأيون المشحون بالشحنة آنيون Anion .
ولقد وضع العالم لويس Lewis تعريفاً للحامض ينص علي أن " الحامض هـو المركب أو الأيون الذي يستقبل زوجاً من الالكترونات . إلا أن التعريف المنسوب للوري وبرونستيد Lowry and Bronsted هو التعريف الأكثر ملائمة من الناحية العملية وينص علي أن الحامض المركب أو الأيون الذي يعطي بروتونات كمـا فـــي المعادلة الآتية :

