

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المتغيرات المؤثرة في سلوك الأدلة
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص 180 -185
2023-09-18
1329
المتغيرات المؤثرة في سلوك الأدلة :
يتأثر مدى الـ pH التي يظهر دليل ما تغير في اللون بدرجة الحرارة ، وبالشدة الأيونية للوسط ، وبوجود المذيبات العضوية ، وبوجود الجزيئات الغروية . يمكن أن يسبب عدد من هذه العوامل ولاسيما العاملان الأخيران في إزاحة مدي التحول بوحـــدة pH أو أكثر .
تفسير عمل الأدلة :
لقد وضعت عدة نظريات لتفسير كيف يتغير لون الدليل في إثناء المعايرة وهي :
1- النظرية الأيونية .
2- النظرية الكروموفورية .
3- النظرية الأيونية الكروموفورية .
تعتمد هذه النظريات الثلاث علي أن الأدلة عبارة عن مركبات عضوية يتم تأينها محلولها أو يحدث تغير في التركيب الجزيئي لها .
أولاً : النظرية الأيونية Ionic Theory -:
تعرف هذه النظرية أدلة الحامض-القاعدة أنها أحماض ضعيفة أو قواعد ضعيفة تتأين في المحلول فيتميز الأيون بلون يختلف عن لون الجزئي غير المتأين ولنفرض أن الرمز العام لدليل الحامضية والقاعدية ذي التركيب الحامضي هـــو HX أي انه عبارة عن حامض ضعيف وأن +H يمثل أيون الهيدروجين و - X يمثل أيون الدليل Indicator ولونه في الوسط الحامضي أصغر وفي الوسط القاعدي أزرق ، وبما انه حامض ضعيف فيمكن أن يمثل بالمعادلة الآتية :


وعند إذابة الدليل في ماء مقطر أو محلوله فإن أيونات الدليل تكون في حالة اتزان مع الجزيء غير المتأين . فالجزيء غير المتأين يكون ذا لون أصفر ، أما أيون الدليل فيكون أزرق اللون ، وبزيادة حامض قوي مثل حامض الهيدروكلوريك فإنه يتـأين ليعطي أيون الهيدروجين الذي يتفاعل مع أيون الدليل - X ومن ثم يزاح الاتزان إلي اليسار حسب قاعدة لوشاتيه وبذلك يظهر اللون الأصفر ، أما إذا أضيفت قاعدة قوية مثل هيدروكسيد الصوديوم فإنها تتأين لتعطي أيون الهيدروكسيد الذي يتفاعل الهيدروجين ومن ثم يزاح الاتزان إلي اليمين ) ويظهر اللون الأزرق ) أي يصبح أيون الدليل هو السائد وسوف نجد أن أيون الدليل - ذو لون يختلف عن لون الجزيئي غير المتفكك أي : يكون أيون الدليل ذا لون ، في حين يكون الجزيء غير المتفكك عديم اللون . ويمكن تعيين ثابت تأين الدليل من العلاقة :

أما الدليل القاعدي فيرمز إليه بالصيغة IndOH معطياً الكاتيون Ind ولونه يختلف عن لون القاعدة IndOH
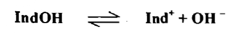
وقد دلت المشاهدات على أن العين البشرية لا يمكن أن تميز لوناً بوجود لون آخـــر إلا إذا كانت درجة تركيزه عشرة أضعاف الآخر على الأقل ، وبناء علي ذلك لا يظهر لون الحامض للعين إلا عندما تتحقق العلاقة :

وعندما تتراوح نسبة القاعدة إلي الحامض بين هاتين القيمتين أي بين 0.1 و 10 يكون لون الدليل وسطاً بين لون الحامض ولون القاعدة وجدير بالذكر ، أن هذه النسبة تمثل معدلاً إذ أن قسماً من الأدلة تستلزم نسباً أكبر أو نسباً أقل من المذكورة وبوضع النسب المذكورة في معادلة ثابت تأين الدليل يمكن تعيين الأس الهيدروجيني للمحلول الذي يظهر بلون الحامض أو بلون القاعدة كالآتي :

يبين الجدول التالي بعض أدلة تفاعلات التعادل :

ثانياً : النظرية الكروموفورية Chromophore Theory:-
تنص هذه النظرية علي أن تغير لون الدليل في أثناء إضافة الحامض أو القاعدة يتم عن طريق حدوث تغير في تركيب جزيئات الدليل أي أنه يحدث للدليل تشابه أيزوميري إذ يحدث تغيير في ترتيب المجموعات والذرات وتكون له أكثر من صورة متشابهة تختلف في تركيبها الكيميائي ومن ثم تختلف في لونها ، فإذا أخذنا دليلاً كالبارنيتروفينول نجده على الشكل الآتي :

يتأرجح الدليل بين الصورتين التركيبيتين السابقتين للدليل نفسه إذ تختلف الصورة اليسري عن الصورة اليمني فالأولي توجد فيها نواة البنزين وهو عديم اللون والثانية فيها نواة الكينويد وهو اصفر ويتحكم في ثابت احدي الصورتين عن الأخرى إضافة حامض أو قاعدة بإضافة حامض الهيدروكلوريك إلى محلول الدليل يتجه التفاعل نحو اليسار وتصبح الصورة التركيبية التي بها نواة البنزين هي الأكثر ثباتاً ومن ثم يكون المحلول عديم اللون . أما إذا أضيفت هيدروكسيد الصوديوم نجد الاتزان يتجــه ناحية اليمين وهذا معناه أن الصورة التركيبية التي بها نواة الكينويد هي الأثبت ومن ثم يصبح لون المحلول أصفر ,
ثالثاً : النظرية الأيونية الكروموفورية Ionic Chromophore Theory:
لما كانت الأدلة تتأين في محاليلها ويختلف تبعاً لذلك لون الجزيء عن لون الدليل ولما كانت الأدلة أيضاً يختلف تركيبها في محاليلها ويختلف تبعاً لذلك لون الصورة التركيبية الأولي عن الثانية وبما أن التغير في كلا الحالتين يتوقف علي إضافة الحامض أو القاعدة في إثناء المعايرة فقد وضعت النظرية الأيونية الكروموفورية لجمع التفسيرين معاً كما يأتي :
نأخذ دليل البارانيتروفينول مثالاً فنجد انه بوصفه جزيئاً يحدث له تشابه بـــين صورتين أ ، ب وأحدي هاتين الصورتين ( ب ) تتأين ومن ثم يصبح الأيون صورة ثالثة ( جـ ) للدليل ويحدث اتزان بين الصورة (أ) والصورة ( ب ) من جهة واتزان بين الصورة ( ب ) والأيون من جهة أخرى

وبإضافة حامض إلى محلول الدليل في إثناء المعايرة يوفر أيونات الهيدروجين التي تتحد أيون الدليل فيتجه الاتزان ناحية اليسار (أ) ومن ثم تتكون الصورة مع ( ب ) فالصورة ( أ ) وتصبح الصورة (أ) هي الأثبت ويصبح المحلول عديم اللون . وعند إضافة قاعدة في أثناء المعايرة توفر أيونات الهيدروكسيل التي تتحـد مــع هيدروجين الدليل ومن ثم يزاح الإتزان ناحية اليمين. وتتكون الصورة ( ب ) فالصورة (جـ) وتصبح الصورة (جـ) هي الأثبت ويصبح المحلول ملوناً بلون أصفر.