

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
العوامل المختزلة المهمة
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص219 -222
2023-09-19
2365
1- ثاني أكسيد الكبريت 2 SO أو حامض الكبريتوز و H2SO4 :
عندما يذاب SO2 في الماء يكون حامض الكبريتوز الذي هو مختزل قوي ويقوم علي أساس تحول أيون الكبريت Sulphite SO3-2 إلـ أيون الكبريتات Sulphate إذ يتحول العدد التأكسدي للكبريت من +4 إلى +6 وعليه ينطلق الكترونات في العملية :
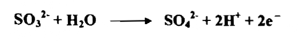
يستعمل الكاشف أحياناً بزيادته علي شكل كبريتيت الصوديوم Na2SO3 إلى المحلول المخصص المراد اختزاله واليك عدداً من التفاعلات مع الـ SO4-2 .
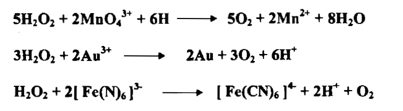
2 - كبريتيد الهيدروجين H2S :
يستعمل غاز كبريتيد الهيدروجين محلوله المائي المشبع بوصفة مرسياً في التحليل الوصفي غير العضوي فإذا وجدت أيونات مؤكسدة في المحلول مثل Cr2O2 أو -4 MnO أو 3+Fe أو 3-ASO 4 أو مواد مثل HNO3 أو 2 Cl فإنها تعاني تأكسداً فيتكون عنصر الكبريت S .
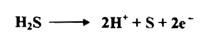
وان رواسب الكبريتيدات المتكونة ستحتوي لذلك على الكبريت الحر . وإن المعادلات الآتية توضح هذه الحالة

3- حامض الهيدروايوديك HI ( أيون الأيوديد I) : -
إن أيون الأيوديد يختزل عدداً من المواد ويتأكسد بدوره إلى اليود

إذ يتغير العدد التأكسدي لليود من 1- إلى الصفر يزاد أيون الأيوديد غالباً على شكل KI ويجري الاختزال بـ -I كما يأتي :

إذا ما حمض محلول KI بحامض الهيدروكلوريك المركز وترك المحلول معرضاً للهواء فإنه يتحول إلي اللون الأصفر ببطء
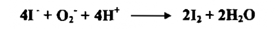
4 - كلوريد القصديروز SnCl2 :
إن أيون القصدير الثنائي Sn+2 مختزل قوي أمين ، إذ يتأكسد إلي القصـدير الرباعي 4+ Sn وذلك بفقدان الكترونين .

ولذلك لا يمكن حفظه معروضاً بالهواء .
5- الفلزات كالحديد والألومونيوم والزنك :
تستعمل هذه الفلزات غالباً بوصفها عوامل مختزلة وإن فعلها يعود إلى تكوين أيوناتها وإطلاق الكترونات أي أنها تتحول من أوطأ حالة تأكسد ( تكاف) لها أيوناتها.
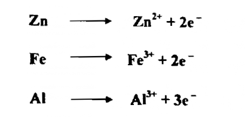
ويمكن استعمال الزنك مثلاً عاملاً مختزلاً في كل من المحيط الحامضي والمحيط القاعدي
