

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
نظرية الأكسدة والاختزال العيارية Theory of Redox Titratons
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص 230-238
2023-09-19
1539
تغير جهد القطب في أثناء معايرة مادة مختزلة بمادة مؤكسدة . وفي حالة المعايرة التأكسدية يمكن أن نأخذ أولاً مثالاً على ذلك حالة بسيطة من هذا النوع من التفاعلات التي تتضمن تبدلاً تكافئيا فقط في الأيونات ، ولا تعتمد نظرياً على تركيز الهيدروجين والمثال الملائم لهذه الأغراض التوضيحية معايرة 100سم3 من محلول N Fe(II) مع سيريوم 0.1 بوجود حامض الكبريتيك المخفف .
ان معادلة التفاعل التأكسدية الاختزالية لهذا التفاعل هي
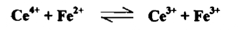

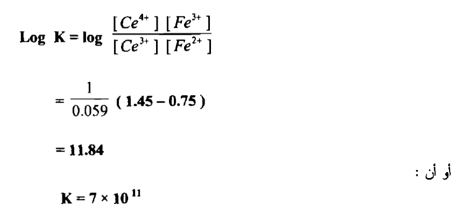
وتدل قيمة ثابت التوازن الايجابية العالية علي أن التفاعل يجري بصـــــورة تـامــــة وكاملة وهو صالح لإجراء المعايرة والتعين الكمي للحديد في أثناء زيادة محلول سيريوم (IV) إلى أن تصل إلى نقطة التكافؤ يكون تأثيره هو في أكسدة الحديد الثنائي وبالنتيجة تبدل النسبة .
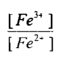
فعند زيادة 10سم3 من محلول الكاشف المؤكسد وهو محلول Ce+4 إلى 100 سم3 من محلول الحديد الثنائي يصبح الحجم الكلي 110سم وعليه فإن تركيز Fe+3 المتكون يكون :



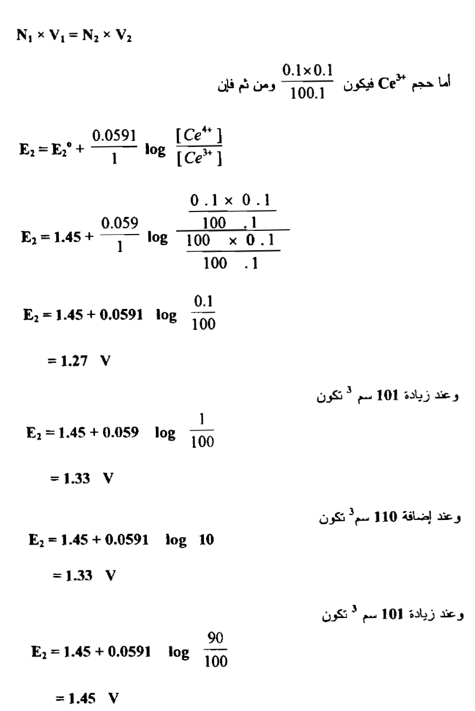
ومن ربط العلاقة بين الحجوم المزادة من محلول الكاشف المؤكسد وقيم جهود الاختزال المحسوبة نحصل علي الشكل التالي
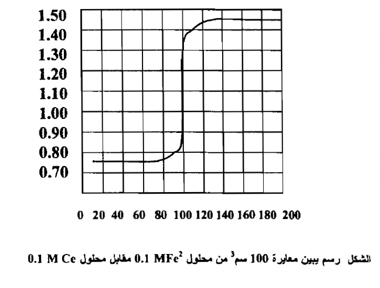
ولغرض استنتاج الصيغة الرياضية التي مر ذكرها لحساب جهد القطب عند نقطة التكافؤ نتبع ما يأتي :
فللتفاعل التأكسدي الاختزالي .
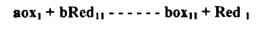
حيث a , b عدد الالكترونات المفقودة والمكتسبة في الحالتين يكون الجهد عند نقطة التكافؤ
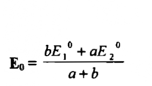

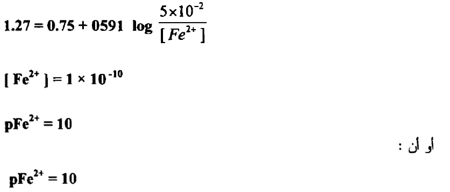
وهكذا فإن pFe2+ تتغير عن 4.3 إلى 10 بين 0.1 % قبل و 0.1 % بعد نقطــــة التكافؤ ، إن هذه المقادير ذات أهمية في اختيار الدلائل لاكتشاف نقطة التكافؤ ومن الواضح أن التغير الحاد في الجهد حوالي نقطة التكافؤ يعتمد علي الجهود القياسية لمنظومتي التأكسد والاختزال المتعلقتين ببعضها وعلي ثابت التوازن للتفاعل وهو معتمد على التركيز ما لم تكن صغيرة جداً .