

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المعايرة الفضية Argentimetric Titrations
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص 286-288
2023-09-21
1381
في تفاعلات الترسيب هذه يستخدم محلول قياسي لنترات الفضة ومنحني المعايرة تفاعلات الترسيب يشبه تماماً محنيات المعايرة في تفاعلات التعادل ويمكن أن يرسم المنحني من pCl = -Log Cl-)) وحجم نترات الفضة المضافة .
نفترض أننا نعاير 100 مل من محلول 0.1 عياري كلوريد الصوديوم بمحلول0.1 عياري نترات الفضة
أ ) قبل بدء المعايرة :

ب ) أثناء المعايرة وقبل نقطة التكافؤ :
عند إضافة 10 مل من نترات الفضة
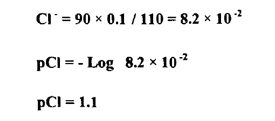
عند إضافة 50 مل من نترات الفضة :
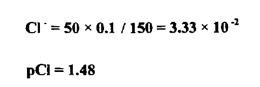
عند إضافة 90 مل من نترات الفضة :
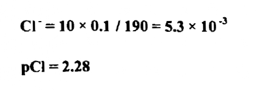
عند إضافة 99.8مل من نترات الفضة :
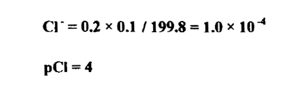
ج ) أثناء المعايرة وقبل نقطة التكافؤ :
عند إضافة 100 مل من نترات الفضة 0.1 عياري إلي 100 مل من كلوريد الصوديوم 0.1 عياري يتكون محلول مشبع من كلوريد الفضة حيث يكون :

د) بعد نقطة التكافؤ :
