
Spontaneity: Free Energy and Temperature
 المؤلف:
University of Missouri System
المؤلف:
University of Missouri System
 المصدر:
Introductory chemistry
المصدر:
Introductory chemistry
 الجزء والصفحة:
.................
الجزء والصفحة:
.................
 22-12-2020
22-12-2020
 2795
2795
Spontaneity: Free Energy and Temperature
In the Gibbs free energy change equation, the only part we as scientists can control is the temperature. We have seen how we can calculate the standard change in Gibbs free energy, ΔG⁰, but not all reactions we are interested in occur at exactly 298 K. The temperature plays an important role in determining the Gibbs free energy and spontaneity of a reaction.
ΔG = ΔH – TΔS
If we examine the Gibbs free energy change equation, we can cluster the components to create two general terms, an enthalpy term, ΔH, and an entropy term, –TΔS. Depending on the sign and magnitude of each, the sum of these terms determines the sign of ΔG and therefore the spontaneity (Table 1.1 “Spontaneity and the Signs of Enthalpy and Entropy Terms”).
Table 1.1. Spontaneity and the Signs of Enthalpy and Entropy Terms
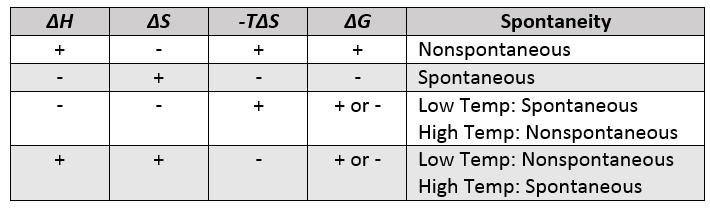
Since all temperature values are positive in the Kelvin scale, the temperature affects the magnitude of the entropy term. As shown in Table 1.1 “Spontaneity and the Signs of Enthalpy and Entropy Terms,” the temperature can be the deciding factor in spontaneity when the enthalpy and entropy terms have opposite signs. If ΔH is negative, and –TΔS positive, the reaction will be spontaneous at low temperatures (decreasing the magnitude of the entropy term). If ΔH is positive, and –TΔS negative, the reaction will be spontaneous at high temperatures (increasing the magnitude of the entropy term).
Sometimes it can be helpful to determine the temperature when ΔG⁰ = 0 and the process is at equilibrium. Knowing this value, we can adjust the temperature to drive the process to spontaneity or alternatively to prevent the process from occurring spontaneously. Remember that, at equilibrium:
ΔG⁰ = 0 = ΔH⁰- TΔS⁰
We can rearrange and solve for the temperature T:
TΔS⁰ =ΔH⁰
T = ΔHo/ ΔSo
Example 6
Using the appendix table of standard thermodynamic quantities, determine the temperature at which the following process is at equilibrium:
CHCl3(ℓ) ⇌ CHCl3(g)
How does the value you calculated compare to the boiling point of chloroform given in the literature?
Solution
At equilibrium: ΔG⁰ = 0 = ΔH⁰- TΔS⁰
We must estimate ΔH⁰ and S⁰ from their enthalpies of formation and standard molar entropies, respectively.
ΔH⁰ = ∑nΔH⁰f(products) – ∑mΔH⁰f(reactants)
ΔH⁰= –102.7 kJ/mol – (–134.1 kJ/mol)
ΔH⁰ = + 31.4 kJ/mol
ΔS⁰ = ∑nΔS⁰ (products) – ∑mΔS⁰ (reactants)
ΔS⁰ = 295.7 J/mol K – (201.7 J/mol K)
ΔS⁰ = 94.0 J/mol K (or 94.0 x 10-3 kJ/mol K)
Now we can use these values to solve for the temperature:
T = ΔHo /ΔSo
T = 31.4 kJ/mol / 94.0 x 10−3 kJ/mol K
T = 334 K = 60.9⁰C
The literature boiling point of chloroform is 61.2⁰C. The value we have calculated is very close but slightly lower due to the assumption that ΔH⁰ and S⁰ do not change with temperature when we estimate the ΔH⁰ and S⁰ from their enthalpies of formation and standard molar entropies.
https://courses.lumenlearning.com/suny-introductory-chemistry/
 الاكثر قراءة في الكيمياء الحرارية
الاكثر قراءة في الكيمياء الحرارية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


