
الأوكسجين في الأطوار المائية Oxygen in the aquatic phase
 المؤلف:
د. حسان صديق / د. نائل يسري
المؤلف:
د. حسان صديق / د. نائل يسري
 المصدر:
كيمياء البيئة
المصدر:
كيمياء البيئة
 الجزء والصفحة:
ص 168-170
الجزء والصفحة:
ص 168-170
 2023-10-25
2023-10-25
 1942
1942
لاتستطيع العديد من الكائنات الحية المائية البقاء على قيد الحياة في بيئتها دون وجود الأوكسجين المنحل يستهلك هذا الأوكسجين، كما رأينا سابقاً، حيث يسهم في تحطيم بعض المواد العضوية. وقد يكون السبب في موت الكثير من الأسماك هو نقص الأوكسجين المنحل بالماء، الناتج عن استهلاكه بتحطيم المواد الملوثة وليس التسمم بها. تأتي معظم كمية الأوكسجين المنحل بالماء من الغلاف الجوي، لذلك فهو متوافر باستمرار، كما يمكن لعمليات التركيب الضوئي، التي تقوم بها الأشنيات والنباتات المنتجة الأخرى، تأمين نسبة من الأوكسجين المنحل، ولكن لا تلبث هذه النباتات أن تستهلك نسبة من الأوكسجين أثناء تنفسها وأثناء تفككها بفعل البكتيريا بعد موتها. فعند دراسة الأوكسجين المنحل في الأوساط المائية، لابد من التميز بين مصطلح انحلالية الأوكسجين oxygen solubility ، الذي يدل على أعظم تركيز للأوكسجين المنحل عند التوازن، وبين تركيز الأوكسجين المنحل dissolved oxygen concentration الذي يختلف عن التركيز التوازني والذي يتحدد بمعدل انحلال الأوكسجين.
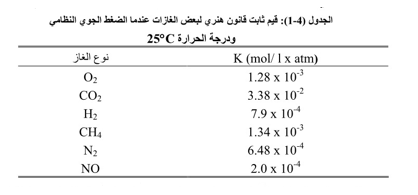
يعتمد انحلال الأوكسجين في الماء بشكل أساسي على درجة حرارة الماء، والضغط الجزئي للأوكسجين في الغلاف الجوي، كما يتأثر بكمية الأملاح المنحلة في الوسط المائي. حيث من الممكن حساب انحلالية الأوكسجين في الوسط المائي كتابع للضغط الجزئي وذلك وفقاً لقانون هنري Henry's Law والذي يعطى بالشكل التالي:

حيث: [(O2(aq] يدل على تركيز الأوكسجين المنحل في الوسط المائي 1 /mol، PO2 الضغط الجزئي للغاز atm و k ثابت قانون هنري 1 atm- . -1 mol. 1 . . يختلف الثابت k من غاز لآخر عند درجة محددة. فمثلاً عند الدرجة °C 25 يعطى ثابت هنري لبعض الغازات المنحلة بشكل أساسي بالماء، وفقاً للجدول التالي:
عند حساب انحلال الأوكسجين في الماء يجب أن يطرأ تعديل في الضغط الجزئي للغاز، وذلك بطرح الضغط الجزئي للماء من الضغط الجزئي للغاز في الهواء. فمثلاً، تعطى القيمة التقديرية للضغط الجزئي للماء، atm 0.0313، عندما يكون الضغط الجوي latm ودرجة الحرارة °C 25 من المعروف أن تركيز الأوكسجين في الهواء الجاف هو %20.95، وبذلك يحسب الضغط الجزئي للأوكسجين من حاصل جداء الضغط بتركيز الهواء:

يلاحظ من القيم السابقة أن تركيز الأوكسجين التوازني والمنحل من الغلاف بالماء منخفض نسبياً، ويمكن استهلاكه بسر. رعة نتيجة تفاعلات تقويض (تفكك) المركبات العضوية ذات المنشأ الحيوي، والتي يمكن تمثيلها بالصيغة { { CH2O ، (التفاعل (4-9)) . هناك حدود لكمية الأوكسجين المنحل عبر الطور الفاصل بين الوسط المائي والغلاف الجوي، إلا إذا أجريت آلية فعالة للتعويض ، كتحريك المياه، أو ضخ هواء من أسفل الوسط المائي :
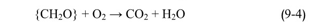
إن وجودmg 7.8 من المركبات العضوية في ليتر من الماء، كفيل باستهلاك ppm 8.32 من الأوكسجين. وبوجود البكتيريا الهوائية الوسيطية، يتناقص تركيز الأوكسجين المنحل بارتفاع درجة الحرارة وفقاً للعلاقة التالية:
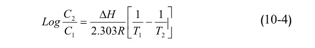
حيث C1 و C2 تركيز الغاز المنحل عند درجتي الحرارة 1T و T2 (حرارة المطلقة) على الترتيب و HΔ كمية حرارة المحلول cal/mol، و R ثابت الغازات العام cal. Deg mol 1.987 كمثال، تبلغ انحلالية الأوكسجين في الماء عند الدرجة 0°C القيمة 1/14.74mg ، وعند الدرجة 35°C تنقص لتصبح 1/7.03mg. يترافق تناقص انحلالية الأوكسجين عند درجات حرارة مرتفعة مع ازدياد معدل تنفس المتعضيات المائية، مما يؤدي إلى نقص كبير في كمية الأوكسجين المنحل.
 الاكثر قراءة في كيمياء البيئة
الاكثر قراءة في كيمياء البيئة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


