


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
أقرأ أيضاً
التاريخ: 25-12-2021
التاريخ: 25-9-2021
التاريخ: 3-9-2021
التاريخ: 25-8-2021
|
وهي تفيد في المساعدة على كشف الحموض الأمينية وفصلها، ويمكن إجمالها في النقاط التالية:
1- الحموض الأمينية كلها من النوع ألفا لأنها، وباستثناء البرولين، تملك مجموعة أمين أولية ومجموعة كربوكسيل على الكربون ألفا (يملك البرولين مجموعة أمين ثانوية).
2- اللون: لا تمتص بلورات الحموض الأمينية الضوء المرئي، ولذا فهي عديمة اللون. كما أنها لا تمتص الأشعة فوق البنفسجية ذات الموجات التي يزيد طولها عن 240 نانومتر، ويستثنى من ذلك الحموض الأمينية الأروماتية: التريبتوفان والفينيل ألانين والتيروزين والهيستيدين التي تمتص، وخاصة الحمض الأول، الأشعة فوق البنفسجية ذات الموجات الطويلة (250-290 نانومتر). ويعتبر التريبتوفان المسؤول الأكبر عن قابلية معظم البروتينات لامتصاص الضوء عند الموجة ذات الطول 240 نانومتر.
3- الذوبانية solubility والانصهار melting: كلّ الحموض الأمينية ذوابة في الماء والمحاليل الحمضية والقلوية المخفّفة والإيثانول، ويستثنى من ذلك التيروزين (ذوبانيته خفيفة في الماء وتزداد مع تسخينه) والسيستين (غير ذواب في معظم المذيبات). كما أن كل الحموض الأمينية لا تذوب في المذيبات غير القطبية كالبنزين والهكسان والإيثر، ويُستثنى من ذلك البرولين وهيدروكسي البرولين اللذان يذوبان في الكحول. ومن ذلك نستنتج بأنه لا يمكن ترسيب الحموض الأمينية في محلول كلور الصوديوم أو سلفات الأمونيوم المستخدمين عادةً، في حين تترسب كلها في الكحول (بالطبع ما عدا البرولين وهيدروكسي البرولين). ومن جهة أخرى، ترتفع درجة حرارة انصهار الحموض الأمينية إلى أكثر من 200 درجة مئوية مما يعكس مدى ارتفاع قيمة الطاقة اللازمة لخلخلة القوى الأيونية (الشاردية) التي تعمل على استقرار البلورات وتثبيتها.
4- المذاق :taste ويكون حلواً مع العديد من الحموض الأمينية (الغليسين والألانين والسيرين والبرولين). أما الأرجينين فمذاقه مر، وأما اللوسين والتربتوفان فلا مذاق لهما.
5 - الفعالية البصرية: إذا استثنينا الغليسين، فإنّ الكربون ألفا في كلّ الحموض الأمينية يكون غير متناظر مما يجعل هذه المركبات قادرة على تدوير الضوء المستقطب أحادي المستوى. وهذا يعني وجود مصاوغين مرآتيين enantiomers (أو بصريين) للحمض الأميني ألفا (أي اليميني D واليساري L)
6- الخصائص الحمضية - القلوية والسلوك المذبذب amphoteric: تحتوي الحموض الأمينية على مجموعتين حمضيتين ضعيفتين قابلتين للتأين على الأقل (الكربوكسيل والأمين)، ولكل منهما شكلان موجودان في توازن بروتوني ويكون أحدهما مشحونا:
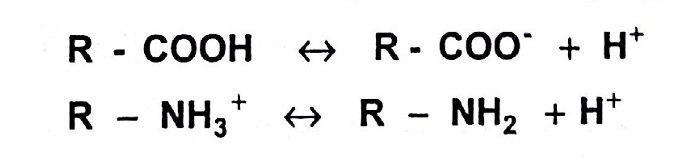
وتشكل المجموعتان الوظيفيتان R-COOH و NH3+ الجزء الحمضي (أو البروتوني) في هذه التوازنات، أما المجموعتان الأخريان فهما الأسس أو القواعد (أي مستقبلات البروتون). وهذا يعني أن الحموض الأمينية يمكن أن تتفاعل مع الحموض والقلويات، ولذلك فهي تدعى بالمركبات المذبذبة amphoteric. ففي الوسط الحمضي يصبح الحمض الأميني هابطة cation ويحمل شحنة موجبة، أما في الوسط القلوي فيصبح صاعدة anion ويحمل شحنة سالبة، وهذا يعني بأن شحنة الحمض الأميني وتفاعله يعتمدان بالدرجة الأولى على درجة حموضة (Ph) الوسط الذي يكون فيه:
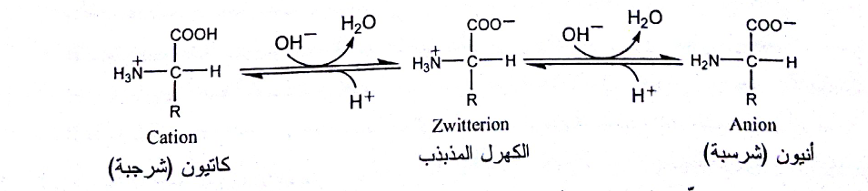
وكما تلاحظ، فإن الشكل غير المتأين لا يمكن أن يوجد في أي قيمة pH، وأنه حتى في درجةPh المنخفضة بما يكفي لتحويل الزمرة الكربوكسيلية إلى الشكل البروتوني، تكون الزمرة الأمينية حتماً في الشكل البروتوني. ولذلك يجب علينا رسم صيغة الحموض الأمينية بالشكل الشاردي. ومع كل هذا، فإننا نستخدم هذه الصيغة اتفاقاً عند دراسة كيمياء الحموض الأمينية.
يُطلق تعبير الكهرل المذبذب zwitterion على الجزيء الذي يحمل العدد نفسه من الزمر القابلة للتأين والحاملة لشحنات متعاكسة (أي أن الشحنة الإجمالية للجزيء مساوية للصفر). وتسمى قيمة PH التي يكون عندها الحمض الأميني بهذا الشكل بنقطة التعادل الكهربي isoelectric point (ويرمزلها i.e.p) أو درجة PH الكهرساوية ioelectric pH (واختصارها Pi)، وهي تمثل متوسط قيم pk (اللوغاريتم السالب لثابتة التفارق) للزمر الكربوكسيلية والأمينية للحمض الأميني.



|
|
|
|
دون أهمية غذائية.. هذا ما تفعله المشروبات السكرية بالصحة
|
|
|
|
|
|
|
المنظمة العربية للطاقة تحذر من خطر.. وهذه الدولة تتميز بجودة نفطها
|
|
|
|
|
|
|
ضمن فعاليات المخيم الربيعي السنوي لطلبتها جامعة العميد تنظِّم زيارة لمجمع الفردوس الترفيهي
|
|
|