


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 12-6-2016
التاريخ: 13-1-2016
التاريخ: 2023-12-20
التاريخ: 16-5-2016
|
الرابطة الايونية Ionic bond
الترتيب الإلكتروني للصوديوم هو 1s22s22p63s1 حيث يحتوي الغلاف الخارجي على الكترون واحد ويتفاعل هذه الذرة مع ذرة اخرى وفقدها الإلكترون الخارجي تصل إلى الترتيب الإلكتروني الثابت 1s22s22p6 ويتحول إلى أيون موجب نتيجة لاحتوائه على أحد عشر شحنة موجبة في النواة.
Na – Na+ + e-
وإذا نظرنا للترتيب الالكتروني للكلور نجده كالآتي 1s22s22p63s23p5 حيث يحتوي على 7 الكترون في المدار الخارجي، وتميل ذرة الكلور لاكتساب إلكترون لكي تتحول إلى الترتيب الإلكتروني الثابت وهو 1s22s22p63s23p6وبهذا تتحول ذرة الكلور إلى أيون سالب نتيجة لاحتوائه على 18 الكترون و 17 شحنة موجبة.
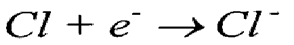
ويمكن في هذه الحالة لأيون الصوديوم الموجب أن يتحد مع أيون الكلور السالب بقوة التجاذب الكهروستاتيكي عن طريق الشحنات المختلفة ونظراً لتحقيق الترتيب الالكتروني الشديد الثبات لكل منهما فإنهما يتحدان لتكوين كلوريد الصوديوم كالآتي
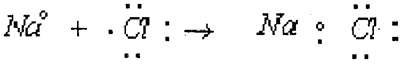
كما هو الحال أيضاً في التفاعل بين الكلور والكالسيوم لتكوين كلوريد الكالسيوم CaCl2




|
|
|
|
دراسة تحدد أفضل 4 وجبات صحية.. وأخطرها
|
|
|
|
|
|
|
العتبة العباسية تحتفي بذكرى ولادة الإمام الجواد (عليه السلام) في مشاتل الكفيل
|
|
|