


 الفيزياء الكلاسيكية
الفيزياء الكلاسيكية
 الكهربائية والمغناطيسية
الكهربائية والمغناطيسية
 علم البصريات
علم البصريات
 الفيزياء الحديثة
الفيزياء الحديثة
 النظرية النسبية
النظرية النسبية
 الفيزياء النووية
الفيزياء النووية
 فيزياء الحالة الصلبة
فيزياء الحالة الصلبة
 الليزر
الليزر
 علم الفلك
علم الفلك
 المجموعة الشمسية
المجموعة الشمسية
 الطاقة البديلة
الطاقة البديلة
 الفيزياء والعلوم الأخرى
الفيزياء والعلوم الأخرى
 مواضيع عامة في الفيزياء
مواضيع عامة في الفيزياء|
أقرأ أيضاً
التاريخ: 30-6-2016
التاريخ: 2023-04-25
التاريخ: 2023-04-25
التاريخ: 2023-05-09
|
الانتروبيا
يمكن تناول مضمون كل من النظام واللانظام ( الفوضى) بطريقتين مختلفتين تماماً، ومع ذلك فإن كلتا هاتين الطرقتين تستخدمان الكمية المعروفة بالأنتروبيا. والأنتروبيا مفهوم ديناميكي حراري أدخله ر. كلوزيوس في منتصف القرن التاسع عشر ليتمكن من وصف النتائج المترتبة على الحقيقة المعروفة بأن الحرارة الذرى للمادة في ذلك الوقت، فقد قام كلوزيوس وبوصف الأنظمة الديناميكية الحرارية بدلالة متغيرات الحالة الماكروسكوبية للنظام P,V,T,U.
لنفرض أن كمية من الحرارة Q قد أضيفت إلى نظام ما بطريقة انعكاسية عند ثبوت درجة حرارته عند القيمة T. في هذه الحالة يعرف التغير الناتج في انتروبيا النظام SΔ بالعلاقة:
(1) 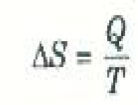
ويتضح من هذا التعريف أن النظام يكتسب الأنتروبيا ( أي أن SΔ يكون موجباً) عندما تنساب الحرارة إلى النظام. ويتبين من المعادلة (1) أيضاً أن وحدات الأنتروبيا هي J/K. ولكنها تقاس أحياناً بالوحدات الحرارية مثل Kcal / k أو cal/K.
لاحظ أن SΔ معروف للعمليات الأيسوثرمية فقط. ومع ذلك فقد تمكن كلوزيوس من إثبات ان الانتروبيا دالة حالة النظام ، كالطاقة الداخلية U. ومن ثم، إذا وجد نظامان ديناميكيان حراريان في نفس الحالة الماكروسكوبية (أي إذا تساوت متغيرات الحالة P,V,T للنظامين)، سيكون للنظامين نفس الانتروبيا. علاوة على ذلك فإن كون الانتروبيا دالة حالة يعني ان التغير في الانتروبيا SΔ لا يعتمد على العملية التي تتغير بها حالة النظام. وقد يبدو للوهلة الأولى أن هذا يتناقص مع المعادلة (1) لأن Q تعتمد على نوع الديناميكية الحرارية المستخدمة في تغيير حالة النظام، ولكن هذا التناقص الظاهري يمكن حله بطرق عديدة منها ما يلي:
1ـ إن أي تغير من الحالة A إلى الحالة B يمكن تحقيقه بعملية أيسوثرمية إلى حالة وسيطة C تتبعها عملية أدياباتية من C إلى B .
2- طبقاً للتعريف، Q تساوي صفراً في حالة التغير الأدياباتي، وعليه فإنSCB=0 Δ
3- وبالنسبة للعملية الأيسوثرمية AC نجد من المعادلة (1) أن SAC=Q/T Δ.
4- إذن، SAB= ΔSAC+ ΔSCB= ΔSAC Δ مهما كان مسار العملية من A إلى B.
والواقع أن النقطة 4 هي الخاصية المميزة لتعريف دالة الحالة. ومن الطبيعي أن حساب ΔSAC يتطلب تعيين الحالة الوسيطة C، وهذا ما يمكن تحقيقه دائماً.



|
|
|
|
مقاومة الأنسولين.. أعراض خفية ومضاعفات خطيرة
|
|
|
|
|
|
|
أمل جديد في علاج ألزهايمر.. اكتشاف إنزيم جديد يساهم في التدهور المعرفي ؟
|
|
|
|
|
|
|
العتبة العباسية المقدسة تنظّم دورةً حول آليّات الذكاء الاصطناعي لملاكاتها
|
|
|