
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
الرابطة الأيونية (Ionic Bond)
المؤلف:
أ.د. محمود محمد سليم صالح
المصدر:
تقنية النانو وعصر علمي جديد
الجزء والصفحة:
ص25–26
2023-07-22
2896
الرابطة الأيونية تتمثل بتجاذب كهربي يربط بين أيونين أيون موجب ناتج عن فقدان ذرة العنصر إلكترونا أو أكثر، وأيون سالب ناتج عن اكتساب ذرة العنصر إلكتروناً أو أكثر.
كيفية عمل الرابطة الأيونية
وهي تتكوّن على إثر التجاذب الكهربائي بين الشحنات الكهربائية الموجبة والسالبة. فيحدث انتقال إلكترون أو أكثر في مستوى الطاقة الخارجي من ذرة إلى أخرى، فتصبح متأينة؛ ولذا تسمى أيونات، وهي إما موجبة أو سالبة. ويمكن لذرات العناصر أن تفقد أو تكتسب أكثر من إلكترون. وتحسب الشحنة الكلية قبل التفاعل من العلاقة الكيميائية التالية:
الشحنة الكلية قبل التفاعل = عدد البروتونات + عدد الإلكترونات.
ويحسب عدد الإلكترونات التي يحتوي عليها مستوى الطاقة الخارجي عبر عدد الإلكترونات الموجودة في المستوى نفسه. فإذا كان المستوى يحتوي على إلكترون واحد (أو أكثر)؛ فبإمكان هذه الذرة إعطاء إلكترون (أو أكثر) لذرة أخرى؛ لتصبح الذرتان مستقرتان أثناء تكوين المركبات الأيونية. فتكون الذرة التي فقدت إلكترونًا (أو أكثر) حاملة شحنة موجبة (+)، وتسمى أيونا موجبا، أمّا الذرة التي اكتسبت إلكترونًا (أو أكثر) فتحمل شحنة سالبة (-)، وتسمى أيونا سالبًا.
والرابطة الكيميائية في ملح كلوريد الصوديوم (انظر الشكلين رقم 8، ورقم 9) مثال على الرابطة الأيونية. ومعلوم لدينا أنّ التوزيع الإلكتروني لعنصر الصوديوم هو: (2، 1،8)، في حين أنّ التوزيع الإلكتروني لعنصر الكلور هو: (2، 7،8).
خصائص المركبات الأيونية
لقد ذكرنا سابقاً أن المركبات الأيونية توجد على شكل تجمعات أيونية في أشكال معينة يطلق عليها الأشكال البلورية. ونجد في هذه الأشكال ترتيباً بلوريا ينظم الأيونات، بحيث يصبح كل أيون ذي شحنة معينة، ويكون منجذبًا نحو مجموعة من الأيونات ذات الشحنة المخالفة، بمعنى أن الأيون الواحد يكون مرتبطاً بعدة روابط أيونية في الوقت نفسه، وهذا ما يفسر وجود المركبات الأيونية عادةً في الحالة الصلبة (كثافة عالية)، كما يفسر هذا الوضع أيضًا درجات الانصهار والغليان المرتفعة لهذه المركبات. ومن أهم صفات المركبات الأيونية عدم قدرتها على التوصيل الكهربي في الحالة الصلبة؛ وذلك نظرا لارتباط الايونات، وعدم قدرتها على الحركة، في حين تصبح موصلة للكهرباء عند صهرها، أو اذابتها في الماء (الايونات حرة الحركة في المصهور، او في المحلول المائي).
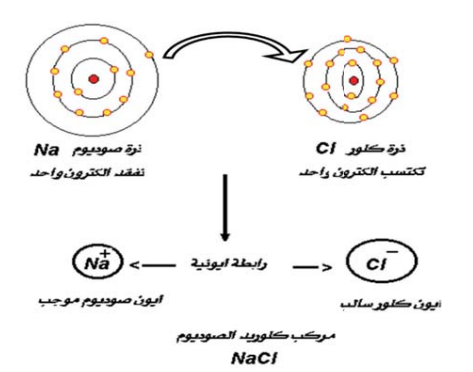
شكل رقم 8 مخطط يوضح الرابطة الايونية لملح كلوريد الصوديوم.
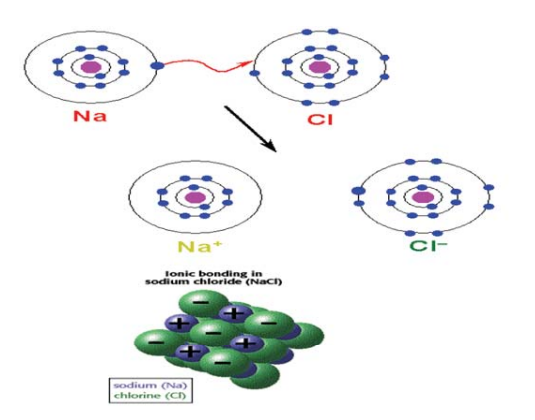
شكل رقم 8 الرابطة الايونية كلوريد الصوديوم.
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















