

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
درجة الحامضية ودرجة القاعدية pH Value and pOH value
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص 171-174
2023-09-18
2610
يمكن القول بأن رقم الحموضة أو الأس الهيدروجيني أو ما يطلق عليه الـ pH ورقم القاعدية أو أس أيون الهيدروكسيل وهو ما يطرق عليه pOH ويعرف الـ pH بأنه اللوغاريتم السالب للتركيز المولاري لأيون الهيدروجين بالجم – أيون / لتر أو اللوغاريتم الموجب لمقلوب تركيز أيون الهيدروجين بالجم – أيون / لتر للأساس10 أي أن :

وباستخدام المعادلة الأولى فإن الرقم الهيدروجيني لمحلول يحوي 3- 10 مول في اللتر من أيونات الهيدروجين هو 3 ، وانه من السهل علينا استعمال الرقم 3 بدلاً من المقدار الأس أو الكسر 3- 10 طالما كان الرقم 3 يوضح المعنى نفسه . ولو أخذنا لوغاريتم الطرفين في المعادلة الأخيرة تتحول إلى صورة كما يأتي :

ويمكن التعبير بالطريقة نفسها عن تركيز أيون الهيدروكسيل برقم مشابه هو رقم القاعدية pOH إذ يساوي اللوغاريتم السالب لتركيز أيون الهيدروكسيل بالجم - أيون / لتر أو اللوغاريتم الموجب المقلوب تركيز أيون الهيدروكسيل بالجم – أيون / لتر ويمكن توضيح ذلك كما يأتي :

ونكتفي عادة في التعبير عن درجة الحموضة أو القاعدية للمحلول برقم pH ويمكن أن نستنج تركيز أيون الهيدروجين والهيدروكسيل بمعرفة تركيز أحدهما وذلك من :
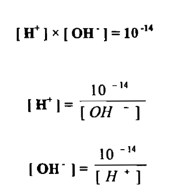
ويتضح من هاتين المعادلتين انه بزيادة تركيز أيون الهيدروجين لمحلول ما يقل تركيز أيون الهيدروكسيل فيه والعكس صحيح بنقص تركيز أيون الهيدروجين يزيد تركيز أيون الهيدروكسيل وبأخذ اللوغاريتم السالب لكل من الطرفين في المعادلة الأساسية يتضح :
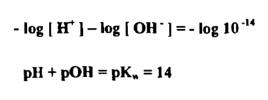
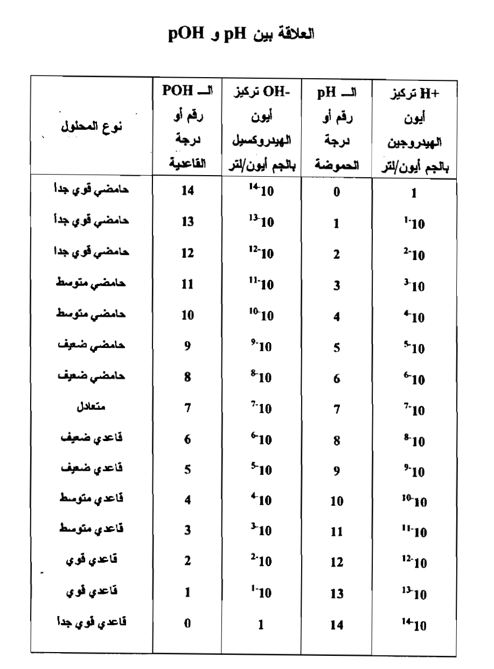
أي انه في أي محلول فإن مجموع رقمي الحموضة يساوي 14 ويمكن توضيح هذه العلاقة في جدول يبين جميع التراكيز من صفر إلي -14 10 لكل من أيون الهيدروجين وأيون الهيدروكسيل ، وكذلك توضح أرقام الـ pH والـ pOH من صفر إلى 14 المقابلة لكل تركيز يبين الجدول التالي العلاقة بين تركيز أيون الهيدروجين والـ pH وبين تركيز أيـــون الهيدروكسيل pOH .
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















