

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
إمتصاص وإنبعاث الأشعة الكهرومغناطيسية
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص 338-339
2023-09-23
1417
عند امتصاص الطاقة من قبل ذرة أو جزيئة تنتقل أو تتحرك الذرة أو الجزيئية إلى حالة ذات طاقة عالية ، ولكل حالة متهيجة عدد معين من مستويات الطاقة وتكون المستويات المتعددة الممكنة من خصائص ذرة أو جزئية معينة ويبين الشكل الآتـي رسماً تخطيطياً بسيطاً لمستويات طاقة ذرة أو جزيئة ، ويشير الخطان الأفقيان إلــى مستويات طاقة الجسيم وأن ° E هي الحالة الإلكترونية المستقرة ذات الطاقة المنخفضة Electronic ground state وان ° E هي الحالة الإلكترونية المتهيجة ذات الطاقة العالية electronic excitedstate عند إعطاء طاقة على شكل حرارة أو ضوء فإن للإلكترون المقدرة على الانتقال من ° E إلى° E .
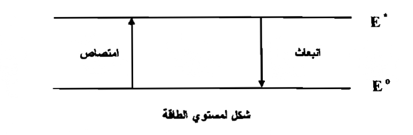
بحيث تكون الذرة أو الجزيئة بعد امتصاص هذه الطاقة في حالة متهيجة ويمكن أن يفقد الجسم وهو في حالة تهيج الزيادة في الطاقة بعدد من العمليات هي :
أولاً : يمكن أن يصطدم الجسيم المنشط مع جزيئات المذيب أو أي جزيئات أخـــري وينقل طاقته إلى محيط هذه الجزيئات .
ثانياً : يمكن أن يصبح الجسيم خاملاً عن طريق تحرير أو إنبعاث الفوتون الذي يكافئ الفرق بالطاقة بين المستويات° E و ° E وفي كلتي الحالتين تنتهي الجزيئــة أو الذرة إلى الحالة الإلكترونية المستقرة .
أن حركة أو انتقال الإلكترون من ° E° - E أي عملية الامتصاص يتطلب إضافة طاقة وأن طاقة هذا الانتقال تساوي الفرق بين مستويات الطاقة . أما الانبعاث يكون علي عكس هذه الحالة إذ يعود الإلكترون من ° E° - E ويصاحب هذه العملية انبعاث فوتون Photon وإن طاقة الشعاع المنبعث تكافئ الفرق بين ° E° - E ويطلق علي توزيع الأشعة الممتصة أو المنبعثة بدلالة الطول الموجي بالطيف Spectrum ويمكن تمييز نوعين من الأطياف ( الأطياف الامتصاصية والأطياف الانبعاثية ) اعتمادا على ميكانيكية التكوين .
ويمكن ملاحظة الأطياف الجزئية في الحالات الامتصاصية والانبعاثية حيث أن الأطياف الانبعائية الجزئية تكون قليلة الأهمية وذلك بسبب ميل هذه الجزيئات علي التكسر أو التفكك عند التهيج . أن تفسير الأطياف الجزئية يعتمد أيضاً على مبدأ اینشتاین Einstein المكافئ والذي تمثل بالمعادلة الآتية :
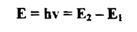
أما بالنسبة للجزيئات ثنائية الذرات diatomic molecules يحدث انتقالات إلكترونية - دورانية واهتزازية فإذا أهمل التداخل بين هذه الانتقالات فإن الفرق في الطاقة يمكن أن يعطي بدلالة ثلاثة حدود مستقلة .

إن حدوث الانتقالات الإلكترونية تسبب تكوين أعظم طاقة حيث أن هذه الانتقالات تكون مقترنة أو متحدة مع الانتقالات الاهتزازية والدورانية ولهذا فإن أطياف الأشعة المرئية فوق البنفسجية للجزيئات تتكون نوعاً ما من الحزم .