

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
العلاقة بين الجهد القياسي ( °E ) وثابت الاتزان ( Keq )
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص 376 -377-378
2023-09-25
2219
يمكن استنتاج العلاقة بين الجهد القياسي ( °E ) وثابت الاتزان ( Keq ) على أساس معادلة التأكسد والاختزال العامة التالية :

وتفيد هذه المعادلة أن المتفاعل الأول في حالة تأكسده ( )1Ox( ) يتفاعل . مع المختزلة للمتفاعل الثاني ( (2) Red ) ليعطي الحالة المختزلة للمتفاعل الأول ( ( 1 )Red ) والحالة المؤكسدة للمتفاعل الثاني ( (2)OX ) وتفاعـــــــلا نصفي الخلية هما :

وبتطبيق معادلة نرنست علي تفاعلات أنصاف الخلية عند 25 °م
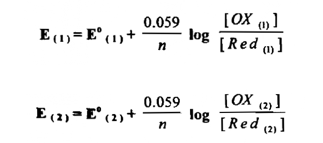
وفي تفاعلات الأكسدة والاختزال فإن الاتزان الكيميائي يصحبه اتزان كهربائي ؛ أي أن جهد نصف خلية التأكسد يساوي جهد نصف خلية الاختزال .


وعليه يمكن حساب ثابت الاتزان لتفاعل الخلية بمعرفة جهدها القياسي تذكر أن قيمة Keq يجب أن تساوي الوحدة أو تكون أكبر منها ؛ لكي يكون التفاعل تلقائياً في الاتجاه المكتوب .