

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
طرق الفصل بالتحكم في الحامضية
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص411 -417
2023-09-26
1760
هناك اختلافات كبيرة موجودة بين الذائبات للهيدروكسيدات والأكاسيد المائية والأحماض لعناصر مختلفة . ويمكن أن يتغير أيضاً تركيز أيونات الهيدروجين أو الهيدروكسيل في المحلول بمعامل مقداره 14 10 أو أكثر ويمكن أن يسيطر عليها باستعمال المحاليل المنظمة ونتيجة لذلك فإن العديد من طرق الفصل التي تعتمد على السيطرة على الدالة الحامضية pH تكون متوفرة من الناحية النظرية لـ وبالممارسة فإن طرق الفصل هذه يمكن أن تجمع في ثلاثة أصناف :
1 - تلك التي تجري في محاليل مركزة نسبياً للأحماض .
2- تلك التي تجري في محاليل تحتوي علي محلول منظم عند قيم متوسطة من الدالة الحامضية pH.
3 - تلك التي تجري في المحاليل مركزة لهيدروكسيد الصوديوم أو البوتاسيوم .
الفصل باستعمال محاليل الأحماض القوية :
ترسب العديد من العناصر كأكاسيد ذات ذوبانية قليلة من محاليل مركزة للأحماض المعدنية . وتتكون هذه المواد الصلبة أحياناً خلال إذابة النموذج ويمكن إزالتها في بداية التحليل . ويترسب التنجستين ( VI ) . التانتوليم ( V ) والسليكون ( IV ) بوصفها أكاسيداً بوجود الأحماض المركزة البركلوريك والهيدروكلوريك والنتريك والكبريتيك . ويكون القصدير والأنتيمون أكاسيداً حامضية بوجود حامض البركلوريك المركز الساخن أو حامض النتريك المركز الساخن ويمكن فصل المنجنيز كثاني أكسيد وذلك بتسخين محلول حامضـــــي لحــــامض البركلوريك أو النتريك لأيون المنجنيز ( II ) مع وجود مؤكسد مثل كلــورات
البوتاسيوم .
ترسيب الأكاسيد القاعدية من المحاليل المنظمة :
تحتاج هذه العملية لقيم عالية من الدالة الحامضية لعملية الفصل التامة ويتضـمن النتائج أن هناك العديد من عمليات الفصل المفيدة يمكن إجراؤها وذلك بالسيطرة الجيدة على الدالة الحامضية باستعمال بعض مخاليط المحاليل المنظمة التي تحافظ على تركيز ملائم لأيون الهيدروجين·
ويحتمل أن يكون المحلول المنظم ( أمونيا - كلوريد الأمونيوم ) الوسط الأكثر شيوعاً في الاستعمال لفصل الحديد ، والكروم والألمونيوم والتيتانيوم من المنجنيز( II ) و هيدروكسيدات الأتربة القلوية . ويبقي النحاس والزنك والنيكل والكوبلت فــــي المحلول بوصفها معقدات أمينية ثابتة . أن الرواسب المتكونة في هذا المحيط غالباً ما تكون جيلاتينية ومن الصعوبة التعامل معها . وأيضاً نتيجة للأدمصاص السطحي التي تميل إلى الترسيب المشارك لقسم من الأيونات الغريبة .
ويوفر ترسيب الأكاسيد المائية للحديد والألومونيوم ، والكروم ، من وسط حامضي طريقة للفصل ملائمة أكثر من الأيونات الثنائية الشحنة الموجبة الشائعة . ونستعمل طريقة الخلات القاعدية التي فيها يتم المحافظة علي الأس الهيدروجيني pH بواسطة المحلول المنظم حامض الخليك - خلات الأمونيوم بصورة واسعة لهذه الغاية . وهناك محاليل منظمة حامضية أخري تكون جيدة الاستعمال مثل حامض البنزويك - بنزويت - حامض الفورميك - الفورمات ، وحامض السيسانيك – سيسنين . وفيما يلي جدول لقيم الأس الهيدروجيني الذي تترسب عنده بعض الأكاسيد .
جدول قيم pH التي تترسب عندها أكاسيد مائية معينة .
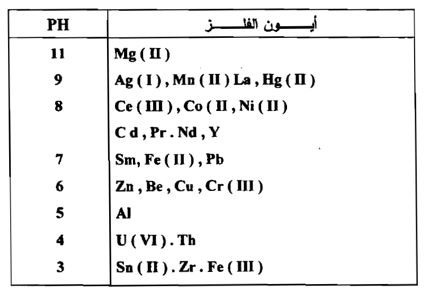
الفصل بإستعمال محاليل القواعد القوية :
في المحاليل القاعدية القوية وبوجود العامل المؤكسد مثل بيروكسيد الصوديوم فإن عدداً من العناصر الأمفوتيرية تكون ذائبة ويمكن فصلها عن الأيونات التي تكون رواسباً تحت هذه الظروف . وهناك فصائل تبقي ذائبة مثل الزنك والكروم والفــــاديوم واليورانيوم وفصائل أخري تكون رواسباً مثل الحديد والكوبلت والنيكل ، وعناصــر الأتربة النادرة .
عمليات الفصل على هيئة كبريتيد :
تكون معظم الكاتيونات كبريتدات شحيحة الذوبان باستثناء الفلزات القلوية وفلزات الأتربة القلوية . إن هذه الكاتيونات تختلف في قابلية ذوبانها اختلافاً كبيراً ، وبسبب سهولة السيطرة على تركيز أيون الكبريتيد للمحلول المائي وذلك بواسطة ضبط الأس الهيدروجيني ولذلك فإن الفصل الذي يعتمد على تكون الكبريتيدات وجد استعمالا واسعاً . حيث يمكن أن تترسب الكبريتيدات من محلول متجانس ، وإن الأيون السالب يجهز إلى المحلول عن طريق التحلل المائي للثاير استامايد·