

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المدارات الذرية
المؤلف:
د. محمد بن إبراهيم الحسن – د. حسن بن محمد الحازمي
المصدر:
أسس الكيمياء العضوية
الجزء والصفحة:
ص14-18
2025-01-04
1568
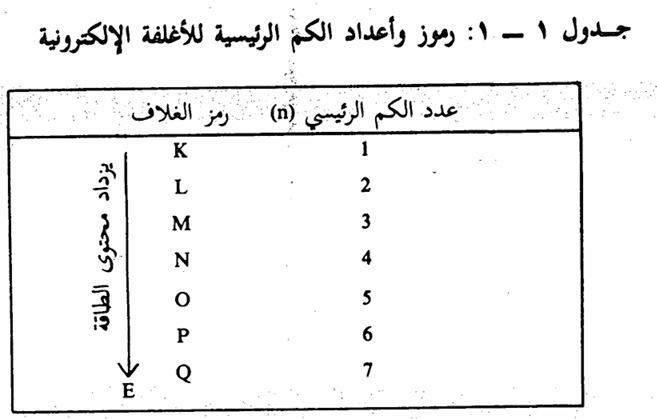
تتكون الذرة من نواة موجبة محاطة بإلكترونات ذات شحنات سالبة. كما ان مجموع الشحنات السالبة مساوى لعدد الشحنات الموجبة في النواة. هذا ويسمى عدد الشحنات الموجبة بالعدد الذري Atomic number تبين الدراسات الطيفية أن الالكترونات موزعة حول النواة في أغلفة متعاقبة (مستويات طاقة) يرمز لها برموز وأرقام، تسمى أعداد الكم الرئيسية. يرمز للغلاف الأول (المستوى الأول بالرمز K، كما أن عدد الكم الرئيسي (n) يساوي واحد (1 n = كما يرمز للغلاف الثاني بالرمز، وعدد الكم الرئيسي يساوي 2 (n=2). هذا الغلاف الأخير يحتوي على مقدار من الطاقة اعلى من المدار الأول وهكذا.
عدد الالكترونات التي يمكن أن توجد في الغلاف الواحد تساوى 2n2. لذلك فإن الغلاف k (n=1) يحتوي على الكترونين كحد أقصى
(2 2(1)=). أما بالنسبة للغلافn=2)L ) فيحتوى على ثمانية الكترونات كحد أقصى (8) = 2(2)2). وهكذا بالنسبة للأغلفة الأخرى الموضحة في
كل غلاف من الأغلفة السابقة يحتوي على الكترونات موزعة في مدارات (غليفات) وهذه المدارات تمثل المناطق في الفراغ والتي يحتمل أن يوجد فيها الالكترون. يرمز لتلك المدارات بالرموزs,p,d,f وهكذا. عدد المدارات في اي غلاف يساوي مربع عدد الكم الرئيسي n2 يحتوي الغلاف) عدد الكم الرئيسي يساوي واحد(على مدار واحد فقط هو مدار (1s) أما الغلاف L (عدد الكم الرئيسي يساوي اثنين( فإنه يحتوي على أربعة مدارات عبارة عن مدار واحد (s2) وثلاثة مدارات (2p) كما أن الغلاف M (عدد) الكم الرئيسي يساوي ثلاثة) يحتوي على تسعة مدارات عبارة عن مدار واحد (3s)، وثلاثة مدارات 3p، وخمسة مدارات (3d).
ويبين الشكل 1 - 1 مستويات الطاقة لكل من مدارات S ، ومداراتP و مدارات d المختلفة في الأغلفة الثلاثة الأولى (k,L,M) المحيطة بالنواة حيث يتضح أن أقل هذه المدارات طاقة هو 1S الذي يقع في الغلاف . K

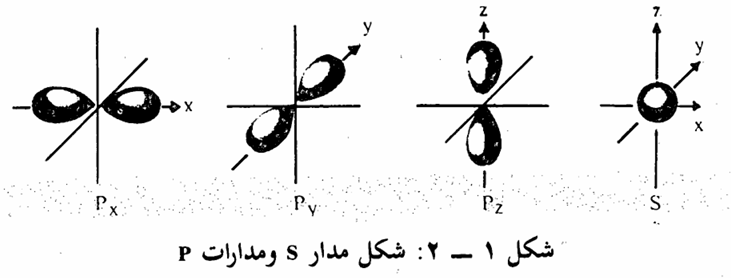
وتأخذ السحابة الالكترونية الشكل الكروي في جميع مدارات s. أما بالنسبة لمدارات p فيتكون من ثلاث مدارات متعامدة، تقع على المحاور الاحداثية الثلاثة، يتكون المدار من فصين متقابلين يفصل بينهما مستوى يسمى بالمستوى العقدي nodel plane ولا يحتمل أن يوجد الالكترون على هذا المستوى (شكل 1 – 2) أما الشكل الذى تأخذه السحابة الالكترونية في d فيتكون من خمسة مدارات كما :
أن f يتكون من سبعة، ولن نتطرق لدراستها لأنه قلما نحتاج لمعرفتها في دراسة المركبات العضوية.
وتجدر الإشارة هنا إلى أن أي مدار من المدارات الذرية مدارات s
ومدارات p الثلاثة ومدارات d الخمسة، ومدارات f السبعة لا
يتسع لأكثر من الكترونين على أن يختلفا في لفهما المغزلي كما تنص عليه قاعدة الاستبعاد لبولي Paul's exclusion principle ويمكن الرمز لدوران الالكترون حول نفسه (اللف المغزلي) بسهم. بحيث نرمز للإلكترونين المتعاكسين في اللف المغزلي هكذا 
أما قاعدة هند Hund's rule فتبين كيفية توزيع الالكترونات في مدارات p الثلاثة والمتساوية في الطاقة. حيث أن نتائج هذه القاعدة تبين أنه لا يمكن لإلكترونين أن يتواجدا في مدار ما حتى يحصل كل مدار من المدارات المتساوية في الطاقة على الكترون واحد على الأقل:
لذلك يمكن ترتيب الالكترونات في ذرة الكربون والتي تحتوي على ستة الكترونات كما يلي:
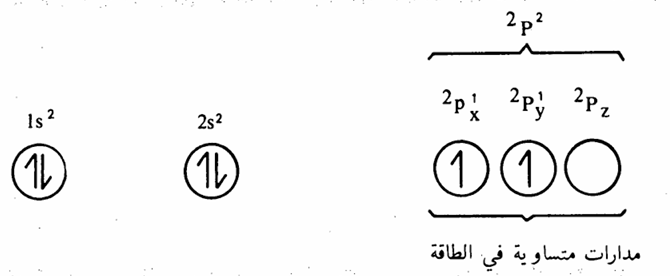
شكل 1 - 3 : الترتيب الالكتروني Electronic configuration لذرة الكربون.
أما بالنسبة لذرة الأكسجين والتي تحتوى على ثمانية إلكترونات، فيمكن ترتيب إلكتروناتها على النحو التالي (شكل 1 – 4).
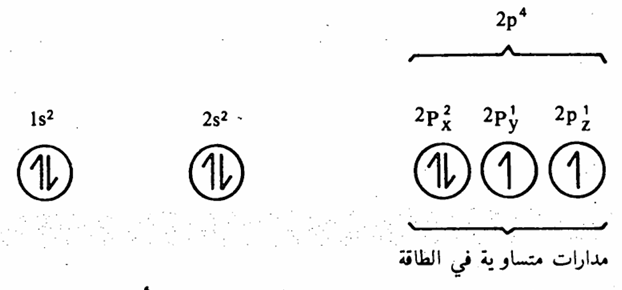
شكل 1 – 4: الترتيب الالكتروني لذرة الأكسجين
ويبين جدول 1 – 2 الترتيب الالكتروني لذرات العناصر الموجودة في الدورة الأولى والثانية في الجدول الدوري.
جدول 1 ـ 2: الترتيب الإلكتروني لذرات العناصر الموجودة في الدورة الأولى والثانية في الجدول الدوري
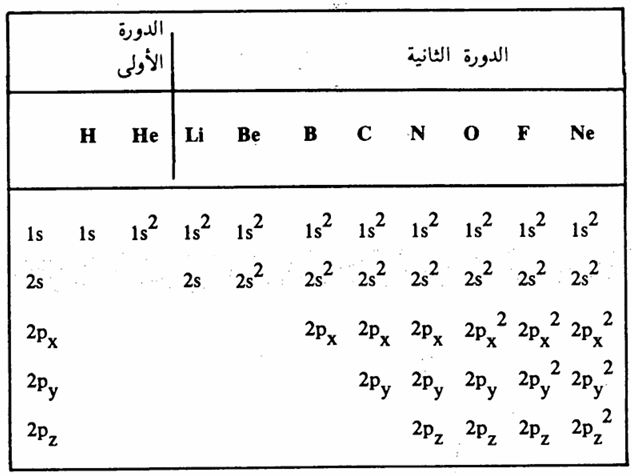
ويدعى الغلاف الخارجي من الالكترونات لكل ذرة بغلاف التكافؤ Valence shell والترتيب الالكتروني لكل ذرة في الغلاف السابق لغلاف التكافؤ يقابل الترتيب الالكتروني للغاز الخامل rare gas السابق لهذه الذرة في الدورة الواحدة من الجدول الدوري. فكما يلاحظ من جدول 1 - 2 أن الترتيب الالكتروني للنيون Ne يطابق السعه الكلية لمدار التكافؤ في ذرات عناصر الدورة الثانية. وجميع الغازات الخاملة تجمعها صفة واحدة وهي وجود ثمانية الكترونات في
الغلاف الخارجي باستثناء غاز الهليوم (الكترونين فقط).
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















