
تعيين الوزن الجزيئي لمذاب في مذيب (من الخواص الجامعة للمحاليل)
 المؤلف:
الإدارة العامة لتصميم المناهج
المؤلف:
الإدارة العامة لتصميم المناهج
 المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
 الجزء والصفحة:
ص57-60
الجزء والصفحة:
ص57-60
 2025-01-28
2025-01-28
 988
988
نظرية التجربة : الخواص الجامعة لمحاليل مكونة من مذاب غير متطاير في مذيب هي أربع خواص تظهر بسبب وجود المذاب وهي كما يأتي:
1- ارتفاع درجة غليان المذيب.
2- انخفاض درجة تجمد المذيب.
3- نقص الضغط البخاري للمذيب.
4- نشوء الضغط الأسموزي
ومن الممكن أن تستخدم أي من هذه الخواص في تعيين الوزن الجزيئي لمذاب بشرط أن يكون التركيز منخفضاً وألا يحدث للمذيب تكسير أو تجميع Dissociation or Association
في حالة الغليانΔ T=Kbm
في حالة التجمد T=KfmΔ
حيث ΔT هو الارتفاع أو الانخفاض.
m هو مولارية المحلول (عدد جزيئات المذاب في كيلوجرام من المذيب).
هو ثابت ارتفاع درجة الغليان المولالي.
هو ثابت انخفاض درجة التجمد المولالي.
ويمكن حساب التركيز m كما يلي:
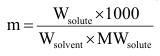
وعلى ذلك يمكن حساب الوزن الجزيئي :
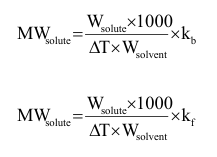
أ- تعيين الوزن الجزيئي من ارتفاع درجة حرارة الغليان
المواد المستخدمة:
1. هكسان حلقي.
.2 نفثالين.
3. سكر.
4. كلوريد الصوديوم.
.5 رابع كلوريد الكربون.
الأدوات المستخدمة:
.1 دورق دائري القعر سعة 100 مل.
2. مكثف عاكس (راد).
3. محرار.
4. حمام مائي.
.5 ماء مقطر.
خطوات العمل:
1- ضع كمية مناسبة من المذيب في الدورق الدائري القعر ثم ركب المكثف العاكس ثم اغمره في الحمام المائي وارفع درجة الحرارة حتى الغليان ثم سجل درجة غليان المذيب.
-2 حضر محلول من المذيب والمذاب حوالي 5% بالوزن.
-3عين درجة غليان المحلول كما في الخطوة (1).
بمعرفة kb للمذيب يمكن حساب الوزن الجزيئي للمذاب MWsolute
من العلاقة السابقة حيث ΔT هو الفرق بين درجة حرارة غليان المذيب والمحلول.
ب- تعيين الوزن الجزيئي من انخفاض درجة التجمد
المواد المستخدمة:
1. نفثالين Naphthalene
2. فينول Phenol.
الأدوات المستخدمة:
1. أنبوبة اختبار كبيرة ( 150مل).
2. محرار.
.3حمام مائي.
خطوات العمل :
1. يضاف حوالي 10جم من الفينول في الأنبوبة ثم تغمر في الحمام المائي ) 70°C) حتى تمام الذوبان مع التقليب مع التقليب بالمحرار ثم ترفع الأنبوبة من الحمام المائي وترصد درجة الحرارة حتى بدء التجمد ثم تسجل درجة التجمد للفينول
2. يضاف حوالي 2جم من النفثالين إلى الأنبوبة السابقة ثم يعاد تعيين درجة التجمد.
3. بمعرفة kf للمذيب يمكن حساب الوزن الجزيئي للمذاب (النفثالين) solute MW
من العلاقة السابقة حيثT Δ هو الفرق بين درجة حرارة تجمد المذيب (الفينول) والمحلول ( الفينول + النفثالين).
4. استعمل قيم kf kb المجودة في الملاحق في نهاية الكتاب.
 الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


