

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Hydrazine and hydroxylamine
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
384
2025-09-07
647
Hydrazine and hydroxylamine
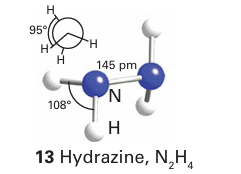
Key point: Hydrazine is a weaker base than ammonia and forms two series of salts. Hydrazine, N2H4 , is a fuming, colourless liquid with an odour like that of ammonia. It has a liquid range similar to that of water (2 114ºC), indicating the presence of hydrogen bonding. In the liquid phase hydrazine adopts a gauche conformation around the NN bond (13).
Hydrazine is manufactured by the Raschig process, in which ammonia and sodium hypochlorite react in dilute aqueous solution. The reaction proceeds through several steps, which can be simplified to
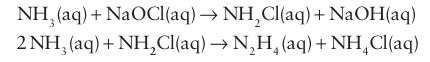
There is a competing side reaction that is catalysed by d-metal ions:
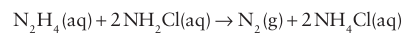
Gelatine is added to the reaction mixture to trap the d-metal ions by forming a complex with them. The dilute aqueous solution of hydrazine so produced is converted to a concentrated solution of hydrazine hydrate, N2H4 .H2O, by distillation. This product is often preferred commercially as it is cheaper than hydrazine and has a wider liquid range. Hydrazine is produced by distillation of the hydrate in the presence of a drying agent such as solid NaOH or KOH.
Hydrazine is a weaker base than ammonia:
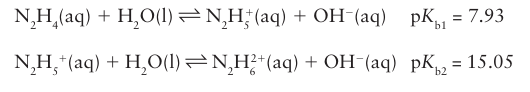
It reacts with acids HX to form two series of salts, N2H5X and N2H6X2. The major use of hydrazine and its methyl derivatives, CH3NHNH2 and (CH3)2NNH2, is as a rocket fuel. Hydrazine is also used as a foam-blowing agent and as a treatment in boiler water to scavenge dissolved oxygen and prevent oxidation of pipes. Both N2H4 and N2H5 are reducing agents and are used in the recovery of precious metals.

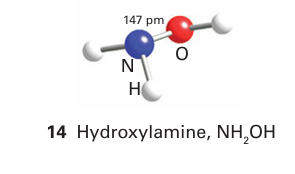
Hydroxylamine, NH2OH (14), is a colourless, hygroscopic solid with a low melting point (32ºC). It is usually available as one of its salts or in aqueous solution. It is a weaker base than either ammonia or hydrazine:
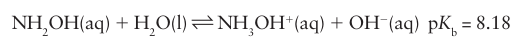
Anhydrous hydroxylamine can be prepared by adding sodium butoxide, NaC4H9 O (NaOBu), to a solution of hydroxylamine hydrochloride in 1-butanol. The NaCl produced is filtered off and the hydroxylamine precipitated by the addition of ether.
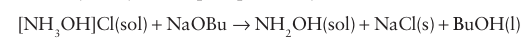
The major commercial use of hydroxylamine is in the synthesis of caprolactam, which is an intermediate in the manufacture of nylon.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















