

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Brönsted-Lowry Definitions
المؤلف:
Jerome L. Rosenberg and Lawrence M. Epstein
المصدر:
College Chemistry
الجزء والصفحة:
p 114
16-7-2017
1693
Brönsted-Lowry Definitions
The difficulty of fitting NH3 into a general scheme of acids and bases was solved in 1923 by Johannes Brönsted and Thomas Lowry, who defined an acid as a proton donor and base as a proton acceptor. Thus NH3 acts as a base and accepts a proton (H+) from H2O, and H2O acts as an acid in donating a proton to NH3.
 (1.1)
(1.1)
The reverse reaction is also an acid-base reaction: NH4+ acts as an acid in donating a proton to the base, OH-. In the Brönsted-Lowry scheme, every acid has a conjugate base and every base has a conjugate acid. Thus NH4+ is the acid conjugate to the base NH3, and OH- is the base conjugate to the acid H2O. Similarly, acetic acid, CH3COOH, donates its acidic proton to H2O to produce the conjugate base, acetate ion, CH3CO2-:
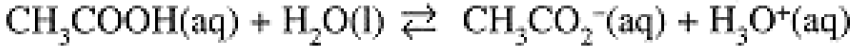 (1.2)
(1.2)
Notice that water can act both as an acid, with conjugate base OH-, and as a base, with conjugate acid H3O+.