تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
Degeneracy of Hydrogen Atom
المؤلف:
Shabnam Siddiqui
المصدر:
Quantum Mechanics
الجزء والصفحة:
153
25-3-2021
2494
Degeneracy of Hydrogen Atom
The energy levels of the hydrogen atom are only dependent on the principal quantum number n and not on other quantum numbers l and m. Thus, by knowing the principle quantum number, the energy levels of the hydrogen atom can be determined. For any value of principle quantum number n, the possible values of l are, l = 0, 1, 2, 3…n − 1. For each l, there are (2l + 1) possible values of m.
This means that many quantum states have the same energy, and therefore, the system is degenerate. For ground state, n = 1, l = 0, and m = 0. For n = 2, energy state, l has two values, l = 0, 1 and for each l, there are corresponding m values. For l = 0, m = 0, and for l = 1, there are three values of m, as m=−1, 0, +1. Therefore, the total degeneracy of the energy level En is:

This property of energy dependence mainly on the principle quantum number is characteristic of the hydrogen atom only and is due to the nature of the coulombic potential. In other atoms, energy is dependent not only on “n” but also on the “l” quantum number, since their potential function deviates from the coulombic potential due to screening effect of other electrons.
Historically, the principle quantum number “n” is called a shell and is denoted as s. Each shell contains n subshells corresponding to the quantum number “l.” Each subshell has (2l + 1) states associated with the quantum number “m.” These energy states of the hydrogen atom are depicted in Figure 1.
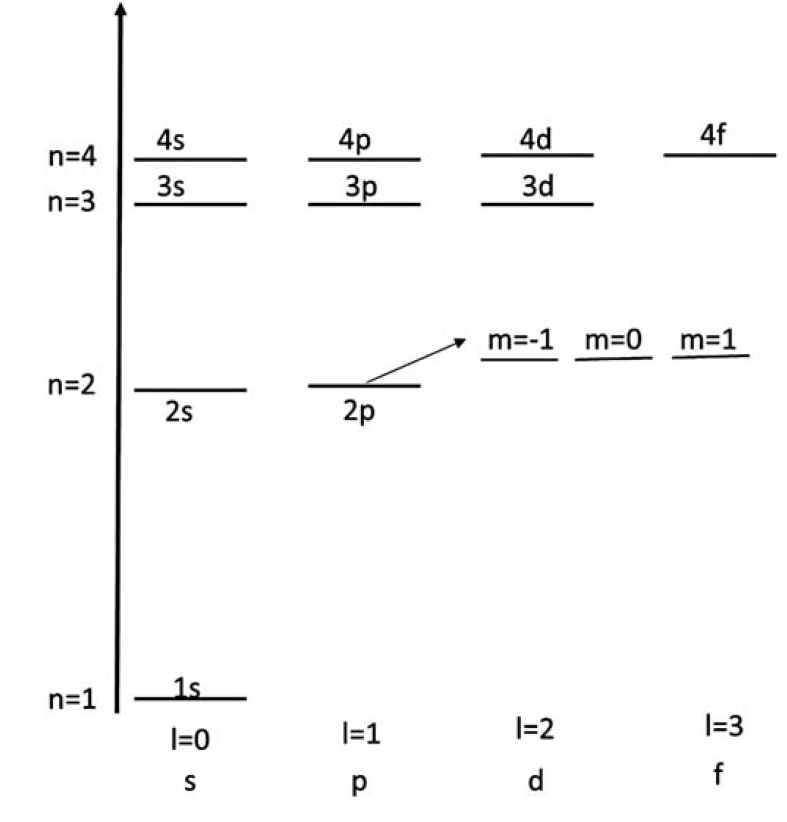
FIGURE 1: Energy states distribution of hydrogen atom, shell and subshells are depicted.
 الاكثر قراءة في ميكانيكا الكم
الاكثر قراءة في ميكانيكا الكم
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)