

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
طرق التحليل الجهدية Potentiometric Methods of Analysis
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اسس الكيمياء التحليلية
الجزء والصفحة:
ص363 -368
2023-09-25
2197
عند وضع قضيب لفلز ما في محلول لأحد أملاحه الذائبة ، فإن كلاً من الفلز والمحلول يحتوي علي أيونات هذا الفلز ، إلا أن فعالية هذه الأيونات تختلف في الفلــــز عنها في المحلول ؛ مما يؤدي بهذا النظام إلى محاولة الوصول إلي حالة أتزان عند نقاط التماس بتأين ذرات الفلز (M) كما يلي :
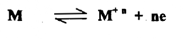
ويلاحظ أن فقدان الأيونات الموجبة من الفلز يترك خلفه زيادة من الالكترونات على سطح الفلز وهي تحاول تقسيم نفسها مقابل الأيونات الموجبة في المحلول ، فينشأ عنه ما يعرف بالطبقة الكهربائية المزدوجة . ونظراً لوجود قوي تنافر بين الشحنات المتشابهة وقوي تجاذب بين الشحنات المختلفة فإن هذا يؤدي إلى انتشار الأيونات الموجبة بين الأيونات السالبة ، خلال المحلول بأكمله لمحاولة الحصول إلى حالة الاتزان ، مع ملاحظة أن سطح الفلز سالب الشحنة في حين أن المحلول المجاور له - تماماً - موجب الشحنة ؛ مما ينتج عنه فرق في الجهد لا يمكن معرفة قيمته المطلقة ، وتعتمد كافة الطرق العملية المستخدمة لقياس فرق الجهد على وجوب وجود منطقة تماس أخري لفلز مع محلوله ، واستكمال الدائرة الكهربائية ، التي تحتوي على جهاز خاص لقياس فرق الجهد
الخلية الجلفانية : Galvanic Cell
إن فكرة الخلية الجلفانية هي عبارة عن انتقال للإلكترونات من العامل المختزل الى العامل المؤكسد . فمثلاً التفاعل بين الخارصين ومحلول كبريتات النحاس ، يتم بنقل زوج من الإلكترونات من الخارصين إلى النحاس كما يلي :

ولو فرضنا أن أنصاف التفاعل تحدث في أقسام منفصلة ، وأن الالكترونات ملتزمة بالسريان في سلك معدني نحصل على تيار كهربائي من خلية كهروكيميائية . ويعرف هذا النوع من الخلايا بالخلية الجلفانية " الفولتية " وتتكون من :
- 1 نصفي خلية : يحتوي كل منها على قضيب من المعدن مغموس في محلول لأحد أملاحه الذائبة ، ويعمل المعدن كقطب ، والمحلول كوسط .
-2 قنطرة ملحية مملوءة بمحلول مركز من كلوريد البوتاسيوم KCI أو نترات البوتاسيوم KNO3 في الجيلاتين ويسمح بالهجرة الأيونية عبر القنطرة إلى نصفي الخلية ؛ للحفاظ على التعادل الكهربائي حول الأقطاب ، ولا يسمح للمحلولين باختلاط بحرية " كي لا يحدث تفاعل مباشر بين ومن ثم لا يحدث سريان الكتروني " .
-3 سلك معدني يصل الأقطاب بجهاز مقياس الجهد " قولتميتر.
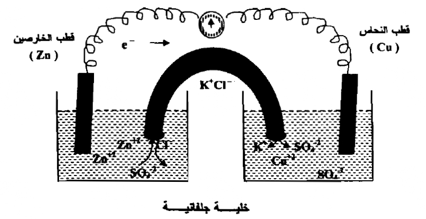
ويسمى القطب الذي تحدث عنده الأكسدة بالكاثود ، والقطب الذي يحدث عنده الاختزال بالأنود ، وفي هذه الخلية يمثل الخارصين الكاثود . فعندما تترك أيونات الخارصين ( +2( Zn قضيب الخارصين ، وتدخل المحلول فإنها تترك خلفها الكترونات ، ويصبح قطب الخارصين سالب الشحنة . والآنود فهو قضيب النحاس الذي تنجذب إليه أيونات النحاس ( Cu2+ ) ؛ وبذلك يصبح موجب الشحنة ، وتمثل هذه الخلية على النحو التالي :

حيث يستخدم خط عمودي واحد يمثل الاتصال بين القطب والمحلول الالكتروليتي وخطان عموديان ليمثلا القنطرة الملحية التي تصل المحلولين ، والقطب الموجب الأنود " على اليمين ، أما القطب السالب - الكاثود " فعلي اليسار
ونتيجة لاختلاف فرق الجهد عند سطحي التماس في نصفي الخلية تجبر الالكترونات على السريان من القطب السالب خلال السلك المعدني إلي القطب الموجب . وتسمى القوة التي تدفع بها الالكترونات خلال السلك بالقوة الدافعة الكهربائية ( . Electromotive force . ( e.m.f ووحدتها الفولت ، أما في حالة الخلية الجلفانية فإنها تسمي بجهد الخلية Cell potential ويرمز له بالرمز ( Ecell ) . وتعتمد قيمته علي عوامل عدة منها : تركيز الأيونات في الخلية أو الضغوط الجزئية لأية غازات تتضمنها تفاعلات الخلية ودرجة الحرارة . وعندما تكون درجة الحرارة 25° م وتركيز الأيونات M 1 والضغوط الجزئية ضغطاً جوياً واحداً فإن جهد الخلية المقاس يسمي بجهد الخلية القياسي ويرمز له بالرمز E( cell ) ° .
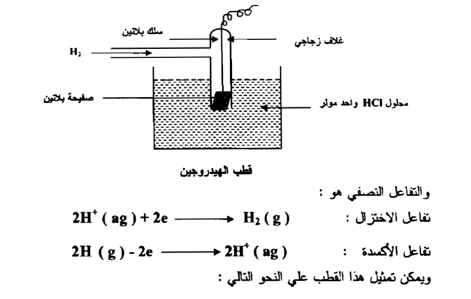
قطب الهيدروجين القياسي : Standard Hydrogen Electrode
يتكون قطب الهيدروجين من صفيحة رقيقة من البلاتين مغطاة بطبقة من البلاتين المجزأ تجزئة دقيقة لتعمل كعامل مساعد متصلة بسلك بلاتيني ومحاطة بغلاف زجاجي يمرر خلاله الهيدروجين تحت ضغط جوي واحد ، ودرجــة حــرارة 25 °م وتغمر في محلول من حامض الهيدروكلوريك تركيزه واحد مولاري . كما في الشكل
التالي :
ويمكن تمثيل هذا القطب على النحو التالي :
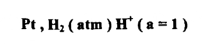
وعند وصل قطب الهيدروجين مع نصف خلية آخر عند الظروف القياسية فإن الجهد المقاس E cell ) ° ( هو جهد الاختزال القياسي ) °E ( للقطب الآخر وأنصاف الخلايا التي تؤدي إلى اختزال أيونات الهيدروجين إلى غاز الهيدروجين " أي لها القدرة على دفــــع الالكترونات في الدائرة الكهربائية أكثر من الهيدروجين " هي القطب السالب في الخلية ، مثل نصف خلية الخارصين
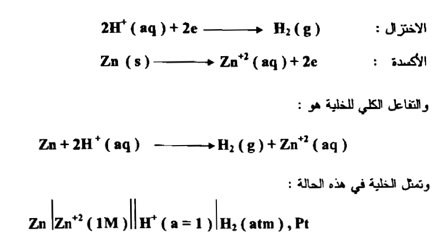
وكقاعدة عامة لحساب فرق الجهد الكلي للخلية نطرح جهد القطب الأيسر من جهد القطب الأيمن ، مع مراعاة أن الناتج يجب أن يكون مقداراً موجباً لتمثـل سـيـر الالكترونات في الاتجاه التلقائي

أما أنصاف الخلايا التي تؤدي إلى أكسدة قطب الهيدروجين " أي أن قطب الهيدروجين يدفع الالكترونات في الدائرة الكهربائية " مثل نصف خلية النحاس فإن جهدها مقدار موجب ، والتفاعلات التي تحدث في الخلية هي :

 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















