


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 1-11-2016
التاريخ: 11-3-2018
التاريخ: 10-3-2018
التاريخ: 26-2-2016
|
تتميز الرابطة بين الأكسجين والهيدروجين في مجموعة الهيدروكسيل بالقطبية ( O - H-). وتنعكس قطبية هذه الرابطة على الخواص الفيزيائية لأفراد طائفة الكحولات فعندما نقارن درجات غليان الكحولات مع درجات غليان الهيدروكربونات المقاربة لها تقريباً، في الأوزان الجزيئية، نجد أن الكحولات تغلي عن درجات أعلى بكثير. على سبيل المثال يغلي 1 - بروبانول (وزنه الجزيئي، 60) عند درجة 97م بينما نجد أن البيوتان النظامي وزنه الجزيئي، 58) يغلي عند درجة الصفر المئوي .
لجزيئات الكحولات القدرة على انشاء روابط هيدروجينية مع بعضها البعض إذ تتجمع هذه الجزيئات وفقاً للآتي:
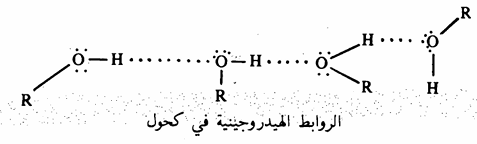
وهذا الترابط الهيدروجيني هو السبب المباشر في ارتفاع درجات غليان الكحولات , تذوب الكحولات البسيطة في الماء بأي نسبة (جدول 7 ـ 1) وابتداء من الفرد الرابع غير المتفرع فإن الذوبانية في الماء تقل تدريجياً بازدياد عدد ذرات الكربون في جزيء الكحول. فالكحولات ذات السلسلة الهيدروكربونية الطويلة نجد أنها أكثر شبها بالهيدروكربونات. ويبين الجدول 7 - 1 الخواص الفيزيائية لبعض الكحولات.
جدول 7 - 1 الخواص الفيزيائية لبعض الكحولات
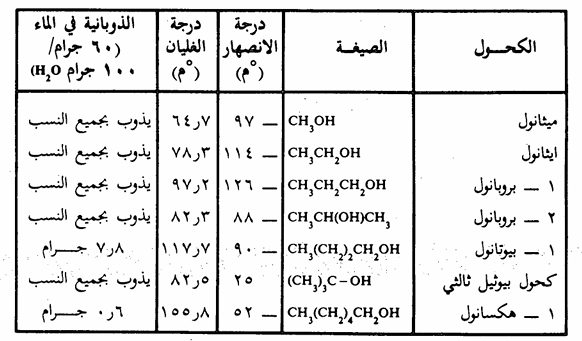
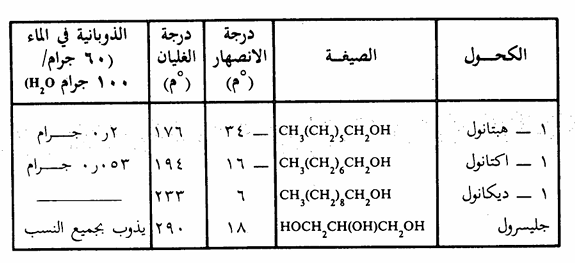
تذوب الايثرات جزئياً في الماء خاصة تلك التي تتكون جزيئاتها من ذرات كربون قليلة، ويرجع ذلك إلى إمكانية تكوين رابطة هيدروجينية بين هيدروجين الماء وأكسجين الايثر كما أنها تذوب في معظم المركبات العضوية، ويعتبر كل من ثنائي ايثيل ايثر ورباعي هيدروفيوران (THE) من أكثر المذيبات الأيثرية العضوية استخداماً في المختبرات.




|
|
|
|
لصحة القلب والأمعاء.. 8 أطعمة لا غنى عنها
|
|
|
|
|
|
|
حل سحري لخلايا البيروفسكايت الشمسية.. يرفع كفاءتها إلى 26%
|
|
|
|
|
|
|
جامعة الكفيل تحتفي بذكرى ولادة الإمام محمد الجواد (عليه السلام)
|
|
|