علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Concentration Cells and the Glass Electrode
المؤلف:
Jerome L. Rosenberg and Lawrence M. Epstein
المصدر:
College Chemistry
الجزء والصفحة:
p 139
19-7-2017
1189
Concentration Cells and the Glass Electrode
Consider a galvanic cell with two Cu electrodes in contact with 0.100 and 0.00100 M solutions of Cu(NO3)2. The standard potential of the cell is E° = 0.000 V. The half-cell and overall cell reactions are:

Such a cell is called a concentration cell since the potential depends only on the concentration ratio for two, otherwise identical, half-cells. This result can be put to good use. Suppose that we want to determine the concentration of a Cu2+ solution. We could place a sample of the solution in contact with a Cu electrode, and join this half-cell with another Cu2+/Cu half-cell with precisely known Cu2+ concentration. The potential of the resulting cell would be a measure of the unknown Cu2+ concentration. The Cu electrode in contact with the Cu2+ solution of unknown concentration is called an indicator electrode, since it ''indicates" the unknown concentration.
An indicator electrode for [Cl-] can be constructed by coating a Ag electrode with insoluble AgCl. The half-cell reaction then is:
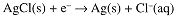
A cell consisting of two Ag/AgCl electrodes in contact with solutions of known and unknown [Cl-] will develop a potential:

The Ag/AgCl electrode is most commonly used as a secondary reference electrode. The hydrogen electrode, the primary reference electrode, is inconvenient to use in practice, since it requires H2(g) and a specially prepared Pt electrode at which the half-reaction is reversible. Thus secondary reference electrodes are usually used in practical electrochemical measurements. A common design for a Ag/AgCl electrode is shown in Figure 15-2. The electrode consists of a Ag wire coated with AgCl, and contained in a tube filled with 0.100 M KCl solution. The tube makes contact with the outer solution through a fiber which allows electrical contact, but with negligible flow of solution. The Ag/AgCl electrode acts as a Cl- indicator electrode because the current which flows to or from such an electrode is carried entirely by Cl- ions. Thus the potential between two Ag/AgCl electrodes is related to the ratio of [Cl-] in contact with the two electrodes. In general, if the electric current is carried by a single species, the potential between solutions A and B is proportional to the logarithm of the concentration ratio CA/CB.
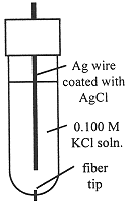
Figure 15-2. A Ag/AgCl electrode.

Figure 15-3. A pH-sensitive glass electrode.
This result has an important application in electrochemical pH measurements (the pH meter) using a glass electrode. A thin membrane of glass can conduct a small electrical current and, in most circumstances, it behaves as though the current carrier is H+. Thus the potential across a glass membrane is proportional to the logarithm of the concentration ratio [H+]inside/[H+]outside. The glass electrode is usually used with another Ag/AgCl/KCl electrode in contact with the test solution. Thus there are three potential-determining processes:
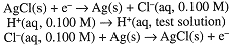
Since both Ag/AgCl electrodes are in contact with the same [Cl-], the potential is determined by the logarithm of the [H+] concentration ratio, and thus is related to the pH of the test solution:
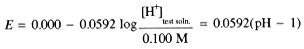
 الاكثر قراءة في الكيمياء الكهربائية
الاكثر قراءة في الكيمياء الكهربائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)