

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
القوى البينية
المؤلف:
أ.د محمد مجدي واصل
المصدر:
اساسيات الكيمياء العضوية
الجزء والصفحة:
ص 26-27-28
2023-07-04
1139
وجد أنه بين الايونات السالبة والموجبة في المركبات الأيونية تجاذب الكتروستاتيكي كبير . فما هو نوع ومقدار قوي التجاذب بين المركبات التساهمية غير القطبية أو بين المركبات التساهمية القطبية . إذ انه تحت ظروف معينة يمكن اسالة غاز الميثان والهليوم.
إذن لابد من وجود قوي تجاذب بين هذه الجزيئات غير القطبية ويستدل من درجة غليان الميثان ( - 161.5° م( على انه يمكن التغلب على هذه القوي بإضافة قليل من الطاقة ، أي ان قوة التجاذب هذه ضعيفة جداً ويطلق على هذه القوى بقوى فاندرفال(Vanderval) .
وهناك بالإضافة الى قوى فاندرفال تجاذب قطب (Dipole - Dipole) بين الجزيئات القطبية ان تجاذب الأقطاب أكبر من قوى فاندرفال ولكنها أصغر من القوى الكهربائية بين الايونات .
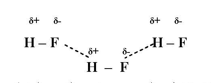
ويمكن الاستدلال على حجم ونوع القوى البينية من درجة الغليان، كما ان هناك علاقة بين درجات الانصهار وقابلية الذوبان.
درجة الانصهار :
درجة الانصهار لمادة هي درجة الحرارة التي تصبح عندها المادة الصلبة في اتزان مع سائلها .إذ أن تحويل المادة الصلبة الى سائل يتضمن تحطيم القوى البلورية ولكل مادة نقية نقطة انصهار معينة.
درجة الغليان :
تعزى الفروق بين نقاط غليان المركبات المختلفة تحت شروط متماثلة الى الفروق في القوى بين الدقائق في الحالة السائلة ففي أي مركب آيوني في حالته السائلة أي منصهرة توجد بين الايونات قوى تجاذب كهربائية عالية ، يجب التغلب عليها عند تحويل السائل الى بخار .
أما في حالة المركبات التساهمية السائلة ، فأن القوى البينية صغيرة ويلزم عندئذ درجة حرارة منخفضة نسبياً للتغلب عليها ، لأنها تحتاج فقط إلي كمية صغيرة من الطاقة . فكلوريد الصوديوم وهو مركب ايوني يغلي في 1413° م بينما يغلي الميثان في 161.5° م .
قابلية الذوبان :
تتضمن إذابة مادة صلبة أو سائلة في مذيب معين انفصال جزيئات المذاب وتوزعها بين جزيئات المذيب ويجب تجهيز المحلول بطاقة للتغلب على قوى التجاذب بين جزيئات المذاب لكي تحدث الإذابة .
أن ذوبان السكر في الماء ناتج عن استبدال قوى التجاذب بين جزيئات السكر من جهة والتجاذب بين جزيئات الماء من جهة أخرى بقوى التجاذب من جزيئات السكر - جزيئات الماء .
ويتوقع ان تذوب الجزيئات أو المواد غير القطبية في المذيبات غير القطبية لان تكوين المحلول يتضمن استبدال قوى فاندرفال بمثلها في هذه الحالة . ولكن المواد القطبية لا تذوب في المذيبات غير القطبية لان الربح الصافي في قوى التجاذب اقل من الطاقة اللازمة للتغلب على قوة التجاذب .