علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
ترتب الهيدروبيروكسيدات
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اساسيات الكيمياء العضوية
الجزء والصفحة:
ص 90 -91 -92 -93-94
2023-07-29
1381
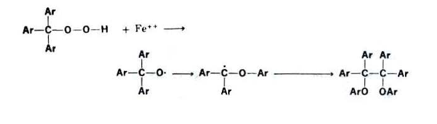
تنشطر الهيدروبيروكسيدات الثانوية والثالثية ( R = الكيل أو أريل (بواسطة الحامض مكونة الكيتونات بواسطة تفاعل تكون فيه الخطوة الأساسية هي الترتب المعادلة التالية :

فعند وجود مجاميع الكيل وآريل سوية في البيروكسيد تكون مجموعة الاريل هي المجموعة المهاجرة المفضلة بينما تكون الهيدروجين هي المجموعة المهاجرة في البيروكسيدات الأولية مكونة الالدهيدات . وفي البيروكسيدات الثانوية مكونة الكيتونات كما في المعادلة التالية :
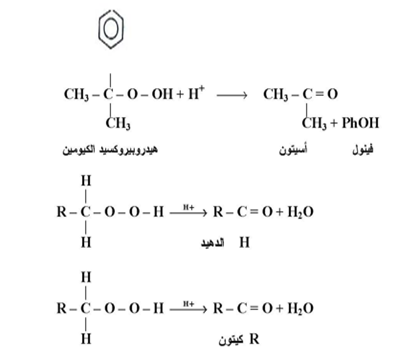
وعند استعراضنا للأمثلة المشار إليها سابقاً يمكن الوقوف عند حقيقة واحدة وهي أن ترتبات البيروكسيدات تحدث بأنتقال ذرة الهيدروجين ، أوالألكيل أو الاريل إلى ذرة الأوكسجين الفقيرة بالإلكترونات من خلال الميكانيكية التالية : -
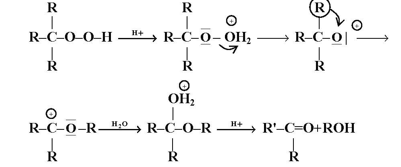
وتتضمن الخطوة الأولى برتنة البيروكسيد مكونة أيون الاوكزونيوم الذي يفقد جزيئة الماء في الخطوة الثائية مكونة مركب وسطي تكون فيه ذرة الأوكسجين فقيرة بالإلكترونات ( تحتوى على ست إلكترونات فقط ) .
حيث يعاني المركب الوسطي الناتج من ظاهرة الترتب ( إزاحة 1 ، 2 ) وذلك من انتقال مجموعة الألكيل أو الاريل في البيروكسيدات الثالثية أو انتقال الهيدروجين في البيروكسيدات الأولية أو الثانوية ( الخطوة 3 ) مكونة أيون كاتيون كاربوني الذي يتفاعل مع الماء مكوناً مركب الهيمي اسيتال ( الخطوة 4 ) .
وينشطر المركب الأخير في الوسط الحامضي مكوناً الكيتونات أو الألدهيدات إضافة إلى الكحول ( الخطوة 5 ) . وعند استعراضنا الخطوات المشار إليها أعلاه لاحظنا أن الخطوة ( 3 ) هي الخطوة المحددة لطبيعة الناتج المتكون حيث أنها تحدد طبيعة المجموعة المهاجرة .
وفي جميع إزاحات -1 ، 2 والتي من ضمنها ترتب البيروكسيدات تكون مجموعة الاريل هي المرجحة في الانتقال عند مقارنتها مع مجموعة الألكيل فمثلاً يترتب هيدروبيركسيد الكيومين مكوناً الفينول والأسيتون ( الطريق أ ) بينما لا يمكن أن يترتب لإعطاء الميثانول والاسيتوفينون (الطريق ب ) كما في المعادلة التالية :
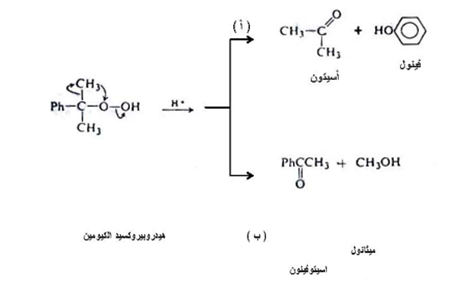
كما أن حدوث الترتب من خلال هجرة مجموعة الاريل وليس الألكيل يوضح من مقارنة الأيون الجسري المتكون كحالة وسطية ففي حالة انتقال مجموعة الميثيل تكون ذرة الكاربون في الأيون الجسري الوسطي خماسية التكافو بينما يؤدي انتقال مجموعة الاريل إلى تكوين أيون البنزونيوم كوسط حقيقي ثابت .

أن تكوين أيون البنزونيوم الوسطي يمكن أن يعزز وذلك من دراسة المركيات الناتجة من ترتبات البيزوكسيدات الخاوية على مجاميع زيل معتفة فلقد وجد أن مجموعة الاريل الحاوية مجموعة واهبة للإلكترونات هي التي تهاجر عند مفاضلتها مجموعة أريل أخرى غير معوضة أو معوضة بمجموعة ساحبة للالكترونات موجودة ضمن نفس جزيئة البيروكسيد .
فمثلاً عند معاملة بارا - نيترو ثلاثي فينيل ميثيل هيدروكسيد مع الحامض يتكون الفينول والبارا - نيترو بنزوفينون كنواتج رئيسية وذك من خلال هجرة مجموعة الفينيل وعدم هجرة مجموعة البارا - نيترو فينيل كما في المعادلة التالية :

إضافة إلى الميكانيكية المشار إليها أعلاه يمكن الإشارة إلى أن ترتب البيروكسيدات هي الأخرى تشابه ترتب هوفمان في إحدى خواصه وهي إنها تحدث ضمن نفس الجزئية ( أي ترتب ضمني وليس بينيا ) . وأخيرا يمكن إن تترتب الهيدروبيروكسيدات بطرق أخرى وبميكانيكية مختلفة عن المذكورة أنفا حيث أنها تترتب بوساطة الجذور الحرة.