

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
متشكلات الهيئة الدورانية
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اساسيات الكيمياء العضوية
الجزء والصفحة:
ص 178-179
2023-08-07
978
إن المجموعات المرتبطة أحادية يمكن أن تعاني دوراناً حول تلك الرابطة بالنسبة لبعضها البعض وأن هذا الدوران يؤدي إلى وجود مركبات متعددة تختلف بمراكز تلك الذرات في الفضاء وتسمى كل من هذه المركبات بالهيئات الدورانية . ولنأخذ جزيء البيوتان مثلا فهناك عدد غير نهائي من الهيئات الناتجة عن الدوران حول رابطة C3 - C2 ولكن ليست جميع الهيئات متساوية في الطاقة وللسهولة سوف نقوم برسم هذه الهيئات بادئين بالهيئة التي تكون فيها مجموعة الميثيل متبادلة بشكل كامل كما بالشكل التالي :
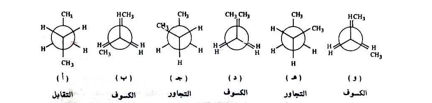
فالهيئة التي تكون فيها مجاميع الميثيل متبادلة بشكل كامل هي الهيئات ثباتا أي أقلها طاقة وتسمى هيئة التقابل ( أ ) وإن ذلك يعود إلى وجود الجزيئة بأقل أجهاد مقارنة مع الهيئات الأخرى ( ب - و ) .
بينما تكون مجموعات الميثيل في هيئات التجاوز ( ج و هـ ) قريبة بعضها من البعض الآخر مما يجعل قوى فان دير فال قوي تنافر وذلك لتقارب السحب الإلكترونية لكلتا المجموعتين أن هذا يجعل هيئة الجوار أعلى طاقة من هيئة التقابل بحوالي 0.8 كيلو سعر / مول
أما هيئات الكسوف ( ب . د .و ) فهي تماثل نهايات عظمى وخاصة هيئة الكسوف (د) فأنها أعلى الهيئات طاقة وذلك لوجود أعلى قوى للتنافر بين مجموعتي الميثيل.