

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تفاعلات الكحولات
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اساسيات الكيمياء العضوية
الجزء والصفحة:
ص307-308-309
2023-08-21
1541
تقسم تفاعلات الكحولات إلى مجموعتين :
1- التفاعلات التي تتم بانشطار رابطة الأكسجين - هيدروجين .
2- التفاعلات التي تتم بانشطار رابطة كربون - أكسجين .
1- تفاعلات انشطار رابطة هيدروكسيل :
أ- التفاعل مع فلز الصوديوم :
تتفاعل الكحولات مع فلز الصوديوم أو البوتاسيوم لتتحول إلى الكوكسيدات الصوديوم مع تصاعد الهيدروجين كما يلي :
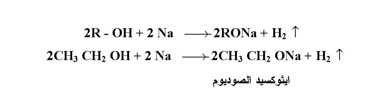
وللالكوكسيدات التي تعتبر قواعد أقوى قليلاً من أيون هيدروكسيد أهمية كبرى في تفاعلات الاستبدال النيوكليوفيلي وتفاعلات الحذف ضمن تحضير الايثرات والألكينات .
ويوضح التفاعل الذي سبق أن الكحولات أحماض ضعيفة ويعود ذلك إلى قطبية رابطة أكسجين - هيدروجين التي تسمح بانطلاق ذرة الهيدروجين بصيغة بروتون . ولكن الكحولات أضعف حامضياً من الماء .
والسبب أن لمجموعات الألكيل في الكحولات تأثير حثي موجب ( 1+ ) فهي تطلق الكترونات في اتجاه ذرة الأكسجين لتزيد من سالبيتها الكهربية وبالتالي تقلل من سهولة انطلاق البروتون من مجموعة الهيدروكسيل .
ونتيجة لذلك يكون تفاعل فلز الصوديوم نشطاً أكثر في حالة الكحولات الأولية ؛ ونتيجة التأثير الحثي فإن الكحولات لا تتفاعل مع هيدروكسيد الصوديوم أو البوتاسيوم المائي .
ب- تفاعل الكحولات مع كلو ربدات الأحماض والانهيدريدات :
تتفاعل الكحولات مع كلوريدات الأحماض في وسيط قاعدي ( مثل البيريدين ) وكذلك مع الانهيدريدات لتعطي أسترات كما يلي :
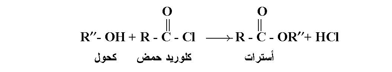
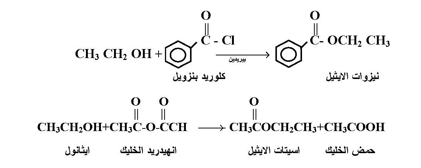
2- تفاعلات انشطار رابطة كربون - أكسجين :
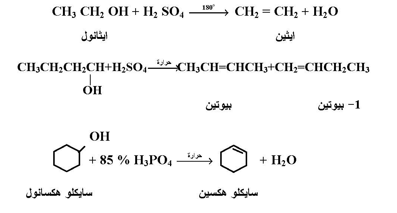
عند معالجة الكحولات بأحماض قوية مثل حمض الكبريتيك أو حمض الفوسفوريك عند درجة حرارة 170 - 180° م يتم إزالة عناصر الماء ويتكون الألكين الأكثر ثباتاً كما بالمعادلات التالية :
أ- تفاعل الكحولات مع هاليدات الهيدروجبن :
تتفاعل الكحولات مع هاليدات الهيدروجين لتعطي هاليدات ألكيل :

ب- تفاعل الكحولات مع هاليدات الفوسفوروالكبريت :
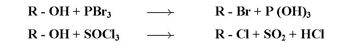
ج- تفاعل الكحولات مع الأحماض الكربوكسيلبة:
تتفاعل الكحولات مع الأحماض الكربوكسيلية في وجود كمية حفزية من حمض الكبريتيك المركز أو غاز Hcl لتعطي الاسترات كما بالمعادلات التالية :
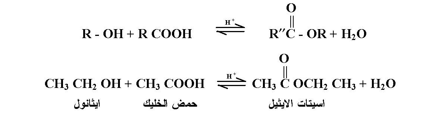
وتفاعل الاسترة تفاعل عكسي ، يمكن دفعه إلى اليمين بزيادة كميةالكحول المستخدم أو إزالة الماء الذي يتكون أثناء التفاعل.