

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تفاعلات المواد العضوية
المؤلف:
د. محمد بن إبراهيم الحسن – د. حسن بن محمد الحازمي
المصدر:
أسس الكيمياء العضوية
الجزء والصفحة:
ص40-42
2025-01-05
111
إن تفاعلات المواد العضوية ليست سوى انفصام (فك) روابط وتكوين روابط أخرى جديدة والروابط في معظم المركبات العضوية هي روابط تساهمية تمثل الواحدة منها بإلكترونين بين الذرتين المرتبطتين. وقد يحدث انفصام بشكل متجانس homolytic حيث تحتفظ كل من الذرتين المرتبطتين بإلكترون، أو بشكل غير متجانس "heterolytic حيث تحتفظ إحدى الذرتين بإلكتروني الرابطة. ولتوضيح ذلك دعنا نلق نظرة على الاحتمالات المتوقعة من انفصام الرابطة بين ذرة X وذرة كربون.
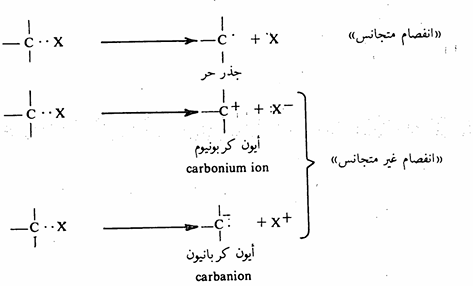
ويحتاج انفصام الرابطة إلى طاقة كما أن تكوينها ينتج عنه طاقة. وطاقة التفاعلات من أهم الأمور التي يتعامل معها دارس الكيمياء عند دراسة التفاعلات الكيميائية. هذا وتختلف كمية طاقة انفصام الرابطة باختلاف الروابط الاحظ جدول 4-2) ) وكذا تختلف كمية الطاقة التي تنتج عن تكوين الروابط.
ويتحدد نوع الانفصام وفقاً للسالبية الكهربية للذرات المرتبطة، فإذا كانت ذرة X في مثالنا أعلاه تتمتع بسالبية كهربية مقاربة لنظيرها في الكربون، عندئذ نتوقع أن يحدث انفصام متجانس. أما لو كانت السالبية الكهربية مختلفة عن نظيرها لذرة الكربون فإن الانفصام المتوقع هو غير متجانس وتتكون الأيونات السالبة (أيون الكربانيون) إذا كانت X أقل سالبية كهربية من الكربون. وتنشأ الأيونات الموجبة أيون الكربونيوم إذا كانت قابلية ذرة الكربون لجذب الالكترونات أقل من ذرة x. ومن مدى قطبية هذه الروابط يمكن إدراك كيفية تكون الأيونات المشحونة. وحيث التفاعلات تحدث عند مراكز الشحنات فإنه يطلق على هذه المراكز جميع بالكواشف ولديها القدرة بالهجوم على روابط الجزيئات العضوية والذي يسفر عنه تكوين روابط جديدة. هذه الكواشف شديدة الفعالية وهي إما أن تكون جذورا حرة (انفصام متجانس) أو أيونات موجبة أو سالبة ويطلق عليها كواشف الكتروفيلية (Electrophiles (E+ وكواشف نيكلوفيلية (Nucleophiles (Nu- على التوالي. وبصورة عامة يعرف الكاشف الالكتروفيلي بأنه الكاشف الذي لديه استعداد لتقبل الالكترونات )يفتقر للشحنة السالبة) أي أنه حمض لويس ويمكن أن يكون موجباً أو متعادلاً مثل:
H+, Br+, NO2, BF3, AICI3,
أما الكاشف النيكلوفيلي فهو الكاشف الذي لديه القدرة على إعطاء الالكترونات (غني بالإلكترونات) أي أنه قاعدة لويس ويمكن أن يكون سالباً أو متعادلاً مثل: HO-, RO-, RS-, CN: H2O: R2N-:
إن تصنيف التفاعلات العضوية يوضح التغيرات التي تحدث على روابط ذرات الكربون التي يحدث عندها التفاعل، ووفقاً لذلك فإنه يمكن تصنيفها إلى ثلاثة أقسام رئيسية:
1- تفاعلات الاستبدال أو الإحلال substitution، حيث تزاح ذرة أو مجموعة مرتبطة بذرة الكربون ويحل محلها ذرة أو مجموعة أخرى

2- تفاعلات الإضافة addition: يشتمل هذا النوع من التفاعلات علي زيادة عدد المجموعات المرتبطة بذرات الكربون حيث يصبح الجزىء مشبعاً.

3- تفاعلات الإنتزاع (الحذف) elimination ويشتمل على نقصان عدد المجموعات المرتبطة بذرات الكربون حيث يصبح الجزىء غير مشبع (تزداد خاصية عدم التشبع بالجزيء).
