

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
حمضية الكحولات (تكوين الأملاح)
المؤلف:
د. محمد بن إبراهيم الحسن – د. حسن بن محمد الحازمي
المصدر:
أسس الكيمياء العضوية
الجزء والصفحة:
ص228-230
2025-01-12
72
نحن نعرف أن الماء يتمتع بصفة حمضية ضعيفة، ويتفاعل مع معادن المجموعة الأولى والثانية في الجدول الدوري فعلى سبيل المثال يتفاعل مع الصوديوم بشدة وينتج غاز الهيدروجين.
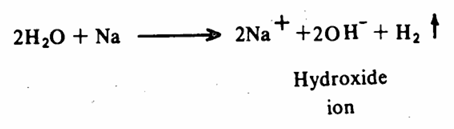
وإذا مارجعنا إلى التركيب البنائي للكحول والمشابه لتركيب الماء، ولكن باستبدال ذرة هيدروجين في الأخير بمجموعة ألكيلية، فإننا نتوقع أن تتفاعل الكحولات مع عناصر المجموعة الأولى والثانية في الجدول الدوري. وهذا حقاً ما تثبته التجربة. فالكحولات تتفاعل مع هذه المعادن ومع عناصر معينة في المجموعة الثالثة أيضاً ولكن بسرعة أبطأ من تفاعل الماء.
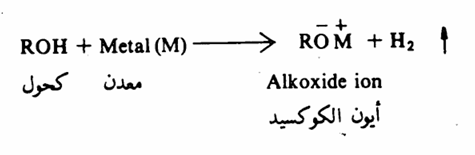
وهذا التفاعل ماهو إلا تفاعل أكسدة واختزال حيث يتأكسد المعدن يفقد الكترونات ويكتسب شحنة موجبة ويختزل البروتون إلى الهيدروجين (2H+ + 2e- ➡H2 )ومن الأمثلة على تفاعلات الكحولات مع المعادن مايلي :
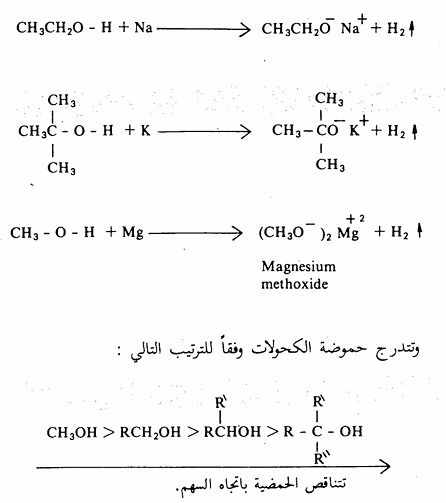
وتتناسب حموضة هذه المركبات طرداً مع ثبات أيون الالكوكسيد، فأيون المثوكسيد أكثر ثباتاً من الكوكسيدات الأخرى ويعزى ذلك إلى تأثير مجموعات الألكيل المانحة حيث أنه من شأنها زيادة الكثافة الالكترونية على ذرة الأكسجين التي تحمل الشحنة السالبة في أيون الالكوكسيد أثناء تكونه وهذا يجعل أيون الكوكسيد الذي يحمل مجاميع ألكيلية كثيرة (ه3) أقل ثباتاً من أيون المثوكسيد لذلك فإن الكحول الميثيلي أقوى حموضة من أقرانه، لذا فإنه يتفاعل مع الصوديوم. مثلا بسرعة فائقة مقارنة بكحول بيوتيل الثالثي. سبق وأن عرفنا أن الكحولات لها حمضية أضعف من الماء، وعليه فإن القاعدة المرافقة أيون الالكوكسيد) قاعدة أقوى من أيون الهيدروكسيد (أقل ثباتاً من أيون الهيدروكسيد) وهذا يعني أنه عند إضافة الكحول إلى محلول مائي من هيدروكسيد الصوديوم فإن حالة الاتزان (حمض - قاعدة تميل نحو الكحول وأيون الهيدروكسيد ولا يحتوي هذا المحلول على قدر يذكر من أيون الالكوكسيد.
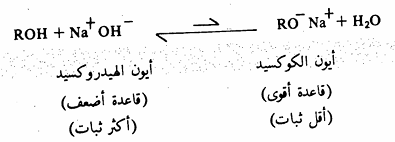
ولما كانت الألكوكسيدات أقوى قاعدية من الهيدروكسيدات فإنها تستخدم كثيراً في الاصطناع المخبري كقواعد وتحضر في العادة بإذابة المعدن في الكحول اللامائي حيث ينشأ الألكوكسيد مذابا في الكحول.