

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تفاعل الكحولات مع هاليدات الهيدروجين
المؤلف:
د. محمد بن إبراهيم الحسن – د. حسن بن محمد الحازمي
المصدر:
أسس الكيمياء العضوية الصفحة: 230-232
الجزء والصفحة:
ص230-232
2025-01-12
71
تتفاعل الكحولات مع هاليدات الهيدروجين وتتكون إثر ذلك هاليدات الألكيل وكما أشرنا سابقاً فإن هذا التفاعل له أهميته في تحضير الهاليدات الألكيلية أي يتم في هذا التفاعل استبدال مجموعة الهيدروكسيل بذرة الهالوجين. ويحفز هذا التفاعل بالحمض ولا يسير بمعدل ملموس مالم يوجد حمض قوي قد يكون هاليد الحمض المستخدم أو قد يكون حامضاً قوياً مثل حمض الكبريتيك.

ولايتم استبدال مجموعة الهيدروكسيل في الكحول نفسه لأن مثل هذا الاستبدال يتطلب استبدال أيون الهيدروكسيد وهو قاعدة قوية حيث أن القواعد الضعيفة في العادة هي. هي التي تمثل مجموعات سهلة الإزاحة (مغادرة جيدة). وترتيب فعالية الكحولات تجاه هاليدات الهيدروجين هو:
Benzyl,allyl >30 >20 > 10 alcohol
الكحولات الثالثية أقوى من الكحولات الثانوية وهذه بدورها أقوى من الكحولات الأولية فالكحول الثالثي يتفاعل مع حمض الهيدروكلوريك المخفف dilute HCl وعند درجة حرارة الغرفة إذ يتكون كلوريد الألكيل المطابق.

أما كلوريد الألكيل الناشيء من الكحول الأولي فلا يتم إلا بالتسخين ومع حمض الهيدروكلوريك المركز conc. HCI.
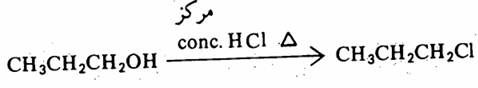
ففي الكحول الأولي يحدث استبدال ثنائي الجزيئية SN2 من الجهة الخلفية لذرة الكربون الأولية أي يحدث تغير في الكيمياء الفراغية لها وهو انقلاب
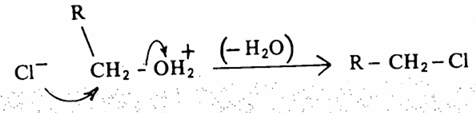
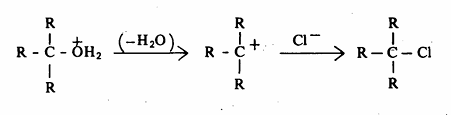
ومن ناحية أخرى فإن أيون الأكسونيوم الناتج من الكحول الثالثي يميل للتأين (تفاعل أحادي الجزيئية للحمض المرافق حيث ينشأ أيون الكربونيوم الثالثي الأكثر ثباتاً من أيون الكربونيوم الأولية والثانوية. وفور تكون أيون الكربونيوم الثالثي ذي الخاصية الالكتروفيلية القوية فإنه يتفاعل مع الكاشف النيكلوفيلي وهو أيون الكلوريد.
أما الكحول الثانوي فيقوم بهذا التفاعل ولكن تحت ظروف وسطية بين تلك الظروف التي يتم عندها تفاعل الكحولات الأولية وبين تلك الظروف التي يتم عندها تفاعلات الكحولات الثالثية ولكنه يخضع في الغالب لميكانية SN1. هناك كشف وصفي يدعى كشف لوكس يستخدم في المختبر على نطاق واسع لتمييز الكحولات الذائبة في الماء إذا ما كانت أولية أو ثانوية أو ثالثية. ويستخدم هذا الكشف )كاشف لوكس عبارة عن حمض الهيدروكلوريك المركز مذاباً فيه ZnCl2. وفي العادة يجري التفاعل عند درجة حرارة الغرفة) للتمييز بين الكحولات وذلك وفقاً للسرعة التي يتم بها تكوين كلوريد الألكيل. فالكحولات الثالثية تتفاعل في الحال مع حمض الهيدروكلوريك المركز حيث يتعكر المحلول في مدة وجيزة، وهذا التعكر يدل على تكوين كلوريد الألكيل المطابق. هذا ومع مرور الوقت فقد ينفصل كلوريد الألكيل على هيئة طبقة زيت أما في حالة الكحول الثانوي فيتأخر التعكر يظهر) كلوريد الألكيل مؤخراً على هيئة طبقة لا تمتزج مع الكاشف) يظهر في زمن من 5 إلى 10 دقائق وذلك في درجة حرارة الغرفة. أما الكحولات الأولية فتبقى ذائبة في الكاشف على هيئة ملح أكسونيوم وعليه لا تنفصل طبقة في المحلول. وإذا كانت مجموعة الألكيل ثالثية أو مجموعة تميل لأن تعطي أيون كربونيوم يتصف بالثبات مثل أيون كربونيوم البنزيل أو الألليل، فهذه الأيونات كواشف الكتروفيلية قوية تتفاعل مع أيون الكلوريد في الحال ويتعكر المحلول أو تنفصل طبقة هاليد الألكيل (غير ذواب في الماء).