

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تفاعل فوق الكبريتات مع اليوديد
المؤلف:
الإدارة العامة لتصميم المناهج
المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
الجزء والصفحة:
ص27-30
2025-01-27
797
نظرية التجربة : المعادلة التالية تعبر عن تفاعل الفوق كبريتات (البير كبريتات) مع اليوديد: K2S2O8 + 2KI→ 2K2SO4 + I2
هذا التفاعل يعتبر من الرتبة الثانية ولكن في حالة وجود تركيز كبير من اليوديد بالمقارنة مع فوق الكبريتات فإن كمية اليوديد المستهلكة في التفاعل تكون ضئيلة يمكن إهمالها وعلى ذلك يصبح معدل التفاعل معتمدا فقط على تركيز مادة واحدة هي فوق الكبريتات وبذلك يمكن اعتبار التفاعل السابق تحت هذه الظروف هو تفاعل من الرتبة الأولى ويعرف هذا النوع من التفاعلات بتفاعل الرتبة الأولى الكاذبة Pseudo-first order ، والمعادلة التي تعبر عن تفاعلات الرتبة الأولى هي:
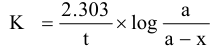
حيث a هو التركيز الابتدائي لفوق الكبريتات X هي الكمية المتفاعلة من اليوديد أو اليود المتكون.
المواد المستخدمة:
1- يوديد البوتاسيوم (M0.2)
2-فوق كبريتات البوتاسيوم (M0.005)
3- ثيوكبريتات الصوديوم ( M0.01).
4- دليل النشا.
5- ماء مقطر بارد
الأدوات المستخدمة:
1- دورق تفاعل (زجاجة محاليل).
2- سحاحة.
3-دورق مخروطي.
4- ماصة مدرجة سعة 10 مل.
5- حمام مائي.
6- محرار.
7- مخبار سعة 50 مل.
8- ساعة إيقاف.
خطوات التجربة :
1- انقل 50 مل من محلول يوديد البوتاسيوم (0.2 M) إلى زجاجة المحاليل ثم أضف إليها 50 مل من محلول فوق كبريتات البوتاسيوم وشغل ساعة الإيقاف مع غلق الزجاجة جيداً حتى لا يهرب اليود.
2- بعد مرور 5 دقائق انقل بالماصة 10مل من مخلوط التفاعل إلى دورق مخروطي يحتوي على حوالي 20مل من الماء البارد ودليل النشا .
3- عاير اليود المتكون باستخدام ثيو كبريتات الصوديوم (0.01) حتى نقطة النهاية وسجل حجم ثيو كبريتات الصوديومVt المكافئة لليود المتكون أي x
4- كرر الخطوتين السابقتين عندما يكون الزمن (35,30,25.20,15,10) دقيقة وما يقابلها من الحجم Vt.
5- بعد ذلك سخن الجزء المتبقي من مخلوط التفاعل إلى 60م ْ لمدة 15 دقيقة في حمام مائي مع ابقاء غطاء زجاجة المحاليل مغلقة ، ثم برد إلى درجة حرارة الغرفة.
6- اسحب 10 مل من مخلوط التفاعل وعايره مع ثيو كبريتات الصوديوم وسجل حجم Vα وهو الحجم المكافئ للتركيز الابتدائي a
الحسابات :
1- حيث إن (حجم الثيو كبريتات عند أزمنة t) يكافئ كمية فوق الكبريتات المتفاعلة x وVα (حجم ثيو كبريتات الصوديوم المكافئة للتركيز الابتدائي a) فإنه يمكن كتابة المعادلة التي تعبر عن تفاعل من الرتبة الأولى على النحو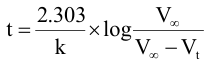
2- سجل النتائج في جدول
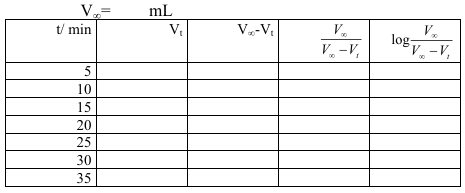
3-ارسم العلاقة بين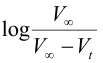 المحور الصادي مع الزمن t (المحور السيني).
المحور الصادي مع الزمن t (المحور السيني).
4- عين ميل الخط المستقيم الناتج ومنه احسب ثابت معدل سرعة التفاعل k .
Slope =2.303/ k
5- أحسب زمن نصف العمر t1/2:
t1/2=0.693/k
 الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















