

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تفاعل هلجنة الأسيتون باليود
المؤلف:
الإدارة العامة لتصميم المناهج
المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
الجزء والصفحة:
ص32-34
2025-01-27
799
نظرية التجربة: تتم هلجنة الأسيتون باليود في وسط حمضي حسب المعادلة:
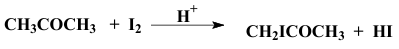
ويعمل الحمض كمحفز للتفاعل ولا تعتمد سرعة التفاعل على تركيز اليود لأنه يدخل في خطوة سريعة ، وعندما يكون تركيز الأسيتون كبيراً جداً مقارنةً بتركيز اليود يصبح التفاعل تفاعلاً من الرتبة الصفرية x=kt حيث X هو تركيز المادة الناتجة في زمن قدره t.
المواد المستخدمة:
1. أسيتون.
2- 10%خلات صوديوم.
3- 1 عياري حمض كبريتيك.
4- 0,1 عياري ثيوكبريتات الصوديوم.
5- 0,5جزيء / لتريود مذاب في 10% يوديد البوتاسيوم.
6. دليل النشا.
7- ماء مقطر.
الأدوات المستخدمة:
1- ماصة مدرجة سعة 25 مل.
2- سحاحة.
3- دورق معايرة سعة 250 مل.
4- زجاجة محاليل قارورة التفاعل) سعة 500 مل.
5- ساعة إيقاف.
6- مخبار مدرج سعة (250، 25مل)
خطوات العمل:
1- ضع الآتي في قارورة التفاعل : 25مل أسيتون و 10مل حمض الكبريتيك و 190 مل ماء مقطر ليصبح الحجم الكلي هو 225مل.
2- ضف إلى قارورة التفاعل 25 مل من محلول اليود ورج بشدة مع تشغيل الساعة .
3- اسحب بعد خمس دقائق من قارورة التفاعل 25مل وضعها في دورق المعايرة الذي يحتوي على 10مل من محلول خلات الصوديوم الذي يستخدم لإيقاف التفاعل ( ملاحظة لا توقف الساعة) وعلى دليل النشا.
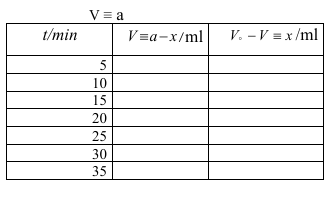
4- عاير دورق المعايرة بمحلول الثيوكبريتات وسجل الحجم الذي يكافئ المتبقي من اليودV.
5- كرر الخطوة (4,3) ولكن على زمن (35.30.25.20.15.10) دقيقة.
6. للحصول على الحجم المكافئ لليود في بداية التفاعل (V) حضر محلولاً يحتوي على:
5 مل محلول اليود و 45 مل ماء مقطر ليصبح الحجم الكلي 50 مل
ثم اسحب 25مل من هذا المحلول وعايره بالثيوكبريتات ويكون حجمها V.
الحساب : للحصول على x نقوم بطرح V من هV
x=V. - V ضع النتائج في جدول ثم ارسم علاقة بين (V -ْV) و t ويكون الميل هو k.
 الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















