

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
التفكك الحفزي لفوق أكسيد الهيدروجين
المؤلف:
الإدارة العامة لتصميم المناهج
المصدر:
أساسيات الكيمياء الفيزيائية (عملي)
الجزء والصفحة:
ًص30-32
2025-01-27
1079
نظرية التجربة: يتفكك فوق أكسيد الهيدروجين تلقائياً حسب المعادلة التالية:
H2O2→ H2O + 1/2O2
ويمكن زيادة سرعة التفاعل بإضافة عامل حافز مثل أكسيد المنجنيز MnO2 ، ويمكن تتبع سير بمعايرة فوق أكسيد الهيدروجين بمحلول قياسي من برمنجنات البوتاسيوم في وسط حمضي.
المواد المستخدمة:
1- محلول (0.125 M) H2O2
2- محلول KMnO4 (M0.05)
3-محلول (1 M)H2SO4
4- مسحوق MnO2 (g0.05)
الأدوات المستخدمة:
1. كأس زجاجي سعة 250 مل.
2. ماصة مدرجة سعة 10 مل.
3.سحاحة
4. دورق مخروطي.
5. مخبار مدرج سعة 250مل.
6. ساعة إيقاف.
خطوات العمل :
1- انقل 150 مل من محلول فوق أكسيد الهيدروجين إلى كأس 250 مل جاف ونظيف
2- أضف (0,05)جم من MnO2 إلى محلول فوق أكسيد الهيدروجين مع تشغيل ساعة الإيقاف
لحظة الإضافة.
3- بعد مرور 3 دقائق أسحب بالماصة 10مل من كأس التفاعل وانقلها إلى دورق مخروطي يحتوي على 10 مل من H2SO4 وعاير بسرعة بواسطة محلول KMnO4 حتى ظهور لون برمنجنات البوتاسيوم.
4- كرر الخطوة السابقة عند أزمنة مختلفة كل خمس دقائق مع تسجيل حجم برمنجنات البوتاسيوم عند كل زمن .
5-عاير المحلول الأصلي لفوق أكسيد الهيدروجين مع برمنجنات البوتاسيوم وذلك بإضافة 10 مل H2SO4 (1 M)
الحسابات :
1- حجم برمنجنات البوتاسيوم عند أزمنة مختلفة تكافئ الكمية غير المتفككة من H2O2 (a-x) .
2-حجم برمنجنات البوتاسيوم في الخطوة رقم (5) يكافئ التركيز الابتدائي (a).
ضع النتائج في جدول كالآتي:

4- ارسم العلاقة بين 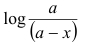 (محور صادي) مقابل t (محور سيني) للحصول خط مستقيم .
(محور صادي) مقابل t (محور سيني) للحصول خط مستقيم .
5- أوجد ثابت معدل سرعة التفاعل (k) فترة نصف العمر (t1/2) حيث أن :
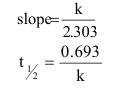
 الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















