
Vapor Pressure Lowering
 المؤلف:
Jerome L. Rosenberg and Lawrence M. Epstein
المؤلف:
Jerome L. Rosenberg and Lawrence M. Epstein
 المصدر:
College Chemistry
المصدر:
College Chemistry
 الجزء والصفحة:
p 92
الجزء والصفحة:
p 92
 16-7-2017
16-7-2017
 1643
1643
Vapor Pressure Lowering
The vapor pressure of a solvent over a solution of nonvolatile solutes is always less than that of the pure solvent at the same temperature. This general result is stated by Raoult's law:
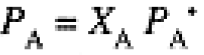 (1.1)
(1.1)
where PA is the vapor pressure of A over a solution with mole fraction XA and PA* is the vapor pressure of pure A at the same temperature. Raoult's law is usually obeyed by the solvent in a dilute solution. We can understand Raoult's law as a consequence of solute molecules or ions diluting the solvent so that the rate of escape into the vapor phase is reduced by the fraction of solute molecules replacing solvent at the liquid-vapor interface, presumably the same fraction as in the bulk solution.
A gas is ideal if the intermolecular interactions are negligible. Most gases behave ideally at low pressures and at temperatures well above the boiling point of the liquid. Liquids have large intermolecular interactions, but we can define an ideal solution as one in which solute-solute, solventsolute, and solvent-solvent interactions are very nearly identical. Such solutions are relatively rare; the only examples are mixtures of very similar molecules, e.g., methanol (CH3OH) and ethanol (C2H5OH), or benzene (C6H6) and toluene (C6H5CH3). Aqueous solutions are always far from ideal since waterwater interactions are so different from the interactions of other molecules. In an ideal solution, Raoult's law is obeyed by a volatile solute as well as the solvent.
Although a volatile solute B generally does not obey Raoult's law, its concentration and partial pressures are nonetheless proportional,
 (1.2)
(1.2)
Eq. (1-2) is known as Henry's law. Kh is a property of the solute and is called the Henry's law constant. Raoult's law is directly responsible for two other properties of dilute solutions: the elevation of the boiling point and the depression of the freezing point.
 الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
الاكثر قراءة في مواضيع عامة في الكيمياء الفيزيائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


