

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Oxides of germanium, tin, and lead
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
365
2025-09-06
88
Oxides of germanium, tin, and lead
Key point: The 2 oxide becomes more stable on going down the group from Ge to Pb. Germanium (II) oxide, GeO, is a reducing agent and disproportionates to Ge and GeO2. The structure of germanium (IV) oxide, GeO2, is based on tetrahedral four-coordinate GeO4 units. It also exists in a six-coordinate crystalline form with a rutile-like structure and in a vitreous form that resembles fused silica. Germanium analogues of silicates and aluminosilicates are also known (Section 14.15). In the blue-black form of SnO the Sn (II) ions are four-coordinate (Fig. 14.11), but the O2 ions around the Sn (II) lie in a square to one side with the lone pair on Sn pointing away from the square. This structure can be rationalized by the presence of a stereochemically active lone pair on the Sn atom and can be described as a fluorite structure (Section 3.9) with alternate layers of anions missing. The red form of SnO has a similar
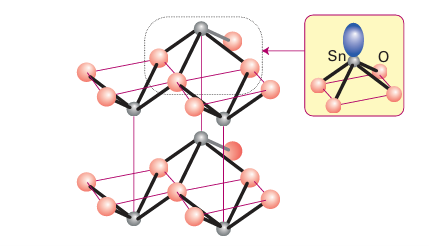
Figure 14.11 The structure of blue black SnO showing parallel layers of square-based pyramidal SnO4 units.structure and can be converted to the blue-black form by heat, pressure, and treatment with alkali. When heated in the absence of air, SnO disproportionates into Sn and SnO2. The latter occurs naturally as the mineral cassiterite and has a rutile structure (Section 3.9). It has low solubility in glasses and glazes, and is used in large quantities as an opacifier and pigment carrier in ceramic glazes to make them less transparent. The oxides of lead are very interesting from both fundamental and technological standpoints. The red form of PbO has the same structure as blue black SnO with a stereochemically active lone pair (Fig. 14.11). Lead also forms mixed oxidation state oxides. The best known is ‘red lead’, Pb3 O4, which contains Pb (IV) in an octahedral environment and Pb (II) in an irregular six-coordinate environment. The assignment of different oxidation numbers to the lead in these two sites is based on the shorter PbO distances for the atom identified as Pb (IV). The maroon form of lead (IV) oxide, PbO2, crystallizes in the rutile structure. This oxide is a component of the cathode of a lead acid battery.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















