

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Phosphine, arsane, and stibine
المؤلف:
Peter Atkins, Tina Overton, Jonathan Rourke, Mark Weller, and Fraser Armstrong
المصدر:
Shriver and Atkins Inorganic Chemistry ,5th E
الجزء والصفحة:
385
2025-09-07
59
Phosphine, arsane, and stibine
Key points: Unlike liquid ammonia, liquid phosphine, arsane, and stibane do not associate through hydrogen bonding; their much more stable alkyl and aryl analogues are useful soft ligands. In contrast to the commanding role that ammonia plays in nitrogen chemistry, the highly poisonous hydrides of the heavier nonmetallic elements of Group 15 (particularly phosphine, PH3 , and arsane, AsH3 ) are of minor importance in the chemistry of their respective elements. Both phosphine and arsane are used in the semiconductor industry to dope Si or to prepare other semiconductor compounds, such as GaAs, by chemical vapour deposition. These thermal decomposition reactions reflect the positive Gibbs energy of formation of these hydrides. The commercial synthesis of PH3 uses the disproportionation of white phosphorus in basic solution:
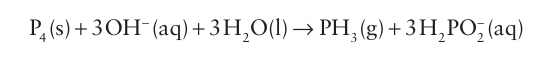
Arsane and stibane may be prepared by the protolysis of com pounds that contain an electropositive metal in combination with arsenic or antimony:
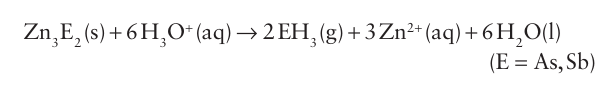
Phosphine and arsane are poisonous gases that readily ignite in air, but the much more stable organic derivatives PR3 and AsR3 (R = alkyl or aryl groups) are widely used as ligands in metal coordination chemistry. In contrast with the hard donor properties of ammonia and alkylamine ligands, the organophosphines and organoarsanes, such as P (C2H5)3 and As(C6H5)3 , are soft ligands and are therefore often incorporated into metal complexes having central metal atoms in low oxidation states. The stability of these complexes correlates with the soft acceptor nature of the metals in low oxidation states, and the stability of soft-donor soft-acceptor combinations (Section 4.12). All the Group 15 hydrides are pyramidal, but the bond angle decreases down the group:
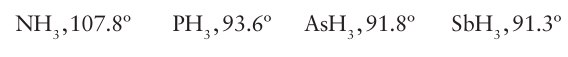
The large change in bond angle has been attributed to a decrease in the extent of sp3 hybridization from NH3 to SbH3 but is more likely to be due to steric effects. The E-H bonding pairs of electrons will repel each other. This repulsion is greatest when the central element, E, is small, as in NH3, and the H atoms will be as far away from each other as possible in a near-tetrahedral arrangement. As the size of the central atom is increased down the series, the repulsion between bonding pairs decreases and the bond angle is close to 90º. It is evident from the boiling points plotted in Fig. 10.6 that PH3, AsH3, and SbH3 are subject to little, if any, hydrogen bond ing with themselves; however, PH3 and AsH3 can be protonated by strong acids, such as HI, to form phosphonium and arsoniumions, PH4+ and AsH4+, respectively.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام) قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)
قسم الشؤون الفكرية يصدر مجموعة قصصية بعنوان (قلوب بلا مأوى)


















